第Ⅱ章 リンパ腫
Ⅱ リンパ腫
9 成人T細胞白血病・リンパ腫
(adult T-cell leukemia-lymphoma:ATL)
総論
成人T細胞白血病・リンパ腫(adult T-cell leukemia-lymphoma : ATL)はヒトT細胞白血病ウイルスI型(human T-cell leukemia virus typeI : HTLV-1)感染に惹起され発症するT細胞腫瘍として疾患概念が提唱され,九州地方を中心とした西南日本に多発する1-5)。WHO分類(2017)では,成熟T細胞性腫瘍の一つとして分類されている6)。
HTLV-1感染者は全世界で約1,000~2,000万人存在し,日本をはじめとして,アフリカ,中南米,カリブ海近辺,オーストラリア,メラネシアなどがendemic areaといわれている。日本のHTLV-1キャリアは108万人と報告されているが,現在はさらに減少傾向にあると考えられる7)。
HTLV-1キャリアが生涯にATLを発症する割合は,2~5%と考えられており,年間約1,000人近くの人が発症する。近年の全国実態調査において,発症平均年齢が68歳と1980年代の調査と比較して高齢化が進んでいる7,8)。病態としては,flower cellといわれる花びら様核形態を特徴とする異常リンパ球の増多を伴う白血球増多症のほか,リンパ節腫脹,肝脾腫,皮疹,高LDH血症,高カルシウム血症,日和見感染症などの多彩な症状が出現する。
1991年にJapan Clinical Oncology Group(JCOG)リンパ腫グループ(LSG)による813例のATL症例の全国調査をもとに,Shimoyamaらにより4つの臨床病型(急性型,リンパ腫型,慢性型,くすぶり型)が提唱された(表1)9)。2012~2013年に発症したATLの全国実態調査によると,急性型51.9%,リンパ腫型24.9%,慢性型12.5%,くすぶり型10.7%であった10)。この病型のなかで急性型,リンパ腫型,予後不良因子(LDH,アルブミン,BUNのいずれか1つ以上が異常値)を有する慢性型は,急速な経過を辿ることが多いことが知られており,アグレッシブATLと呼ばれている。一方で,予後不良因子を有していない慢性型とくすぶり型は,比較的緩徐な経過を呈することからインドレントATLといわれる。現在もこの分類,カテゴリーが,診断,治療方針等に広く活用されている。
表1 ATL臨床病型の診断基準
| 評価項目 | くすぶり型 | 慢性型*1 | リンパ腫型*1 | 急性型*1 | |
|---|---|---|---|---|---|
| 抗HTLV-1抗体*2 | + | + | + | + | |
| リンパ球数(×103/mm3)*3 | <4 | ≧4 | <4 | ||
| 異常リンパ球数*4 | ≧5%*7 | +*8 | ≦1% | +*8 | |
| Flower cell | *5 | *5 | no | + | |
| LDH | ≦1.5N | ≦2N | |||
| 補正Ca値(mg/dL)*6 | <11.0 | <11.0 | |||
| 組織学的に腫瘍病変が確認されたリンパ節腫大 | No | + | |||
| 腫瘍病変 |
皮膚 肺 リンパ節 肝腫大 脾腫大 中枢神経 骨 胸水 腹水 消化管 |
*7 *7 no no no no no no no no |
no no no no no |
yes |
|
空欄は他の病型で規定される条件以外の制約はないことを示す。
N:正常値上限
*1 予後不良因子を有する慢性型:BUN>施設基準値上限,LDH>施設基準値上限,血清アルブミン<施設基準値下限の1つでも満たす場合
*2 PA法あるいはELISA法やWestern blot法,LIA法のいずれかで陽性であること。
Immunofluorescence法,Western blot法やLIA法により陽性反応が確認されていることが望ましい。測定可能な施設では,Southern blot法により,HTLV-1 provirusのATL細胞への組み込みを確認する。
*3 正常リンパ球と異常リンパ球を含むリンパ球様細胞の実数の和
*4 形態学的に明らかなATL細胞
*5 ATLに特徴的なflower cellが認められてもよい。
*6補正Ca値は以下の式で求める。
血清アルブミン値≧4.0(g/dL)の場合:補正カルシウム値(mg/dL)=総カルシウム値(mg/dL)
血清アルブミン値<4.0(g/dL)の場合:補正カルシウム値(mg/dL)=総カルシウム値(mg/dL)−0.8
[アルブミン(g/dL)−4]
*7末梢血中の異常リンパ球が5%未満でくすぶり型と診断されるには,皮膚あるいは肺に組織学的に腫瘍病変が確認されることが必要である。
*8末梢血中の異常リンパ球が5%未満で慢性型または急性型と診断されるには,組織学的に腫瘍病変が確認されることが必要である。
(文献9)を改変)
予後については,2010~2011年に発症した770例の全国予後調査において4年OSは,急性型,リンパ腫型,不良因子を有する慢性型,予後不良因子を有しない慢性型,くすぶり型でそれぞれ16.8,19.6,26.6,62.1,59.8%であった11)。
2000~2009年に診断された全国81施設での807例の急性型,リンパ腫型の後方視的研究において,臨床病期,PS,年齢,アルブミン,可溶性インターロイキン2受容体(sIL-2R)が予後因子として抽出された。有する予後因子の数により3つのリスク群に分けられ,その生存期間中央値(MST)は低,中,高リスク群でそれぞれ16.2カ月,7.3カ月,3.6カ月であった12)。また,JCOG-LSGがアグレッシブATLを対象とし,継続して臨床試験を行ってきたことから,化学療法における反応性の評価ではJCOG治療効果判定規準が広く使用されてきた(表2)。JCOG-LSGで行われた3つの前方視的臨床試験の276例の併合解析では,PSと高Ca血症の有無で2群に分けられ,そのMSTは,6.3カ月と17.8カ月であった13)。さらに70歳以下の急性型とリンパ腫型ATL 1,792例(2000~2013年)の後方視的解析では,病型(急性型),PS,高Ca血症,CRP,sIL-2Rが予後因子として抽出された。有する予後因子の数により3つのリスク群に分類され,MSTは低,中,高リスク群でそれぞれ626,322,197日であった14)。
表2 JCOG版ATLに対する治療効果判定規準(JCOGでのATL臨床試験プロトコールから引用)
[ベースラインで標的病変が存在する場合]
|
総合 効果 |
評価項目 | |||||||
|---|---|---|---|---|---|---|---|---|
| 標的病変 | 非標準的病変 | 骨髄浸潤 | 末梢血病変(異常リンパ球) | 皮膚病変 | 新病変 | |||
| 節性 | 節外性 | 節性 | 節外性 | |||||
| CR | 正常 | 消失 | 正常 | 消失 | 陰性 | 正常 | 正常 | なし |
| PR | SPDの50%以上の縮小 |
正常 or 非増大 |
消失 or 非増大 |
問わない (未検可) |
正常 or 縮小 |
正常 or 縮小 |
なし | |
| SD | CR,PR,PDのいずれにも判定されない | |||||||
| PD | 以下のいずれか1項目でも満たした場合はPDと判定する | |||||||
|
SPDの50%以上の増大 or 節性標的病変の再腫大 or 節外性標的病変の再出現 |
増大 or 再腫大 |
増大 or 再出現 |
陽性化 | 増加 |
増大 or 再出現 |
あり | ||
上記の項目のいずれかでも評価不能であれば総合評価は「評価不能 not evaluable(NE)」とする。
[ベースラインで標的病変が存在しない場合]
| 総合効果 | 評価項目 | |||||
|---|---|---|---|---|---|---|
| 非標的病変 | 骨髄浸潤 | 末梢血病変(異常リンパ球) | 皮膚病変 | 新病変 | ||
| 節性 | 節外性 | |||||
| CR | 正常 | 消失 | 陰性 | 正常 | 正常 | なし |
| PR* |
正常 or 非増大 |
消失 or 非増大 |
問わない(未検可) |
正常 or 縮小 |
正常 or 縮小 |
なし |
| SD | CR,PR,PDのいずれにも判定されない | |||||
| PD | 以下のいずれか1 項目でも満たした場合はPD と判定する | |||||
|
増大 or 再腫大 |
増大 or 再出現 |
陽性化 | 増加 |
増大 or 再出現 |
あり | |
上記の項目のいずれかでも評価不能であれば総合評価は「評価不能 not evaluable(NE)」とする。
*CRの規準を満たす場合,総合効果はCRとする。
参考文献
1) Uchiyama T, et al. Adult T-cell leukemia: clinical and hematologic features of 16 cases. Blood. 1977; 50(3): 481-92.
2) Poiesz BJ, et al. Detection and isolation of type C retrovirus particles from fresh and cultured lymphocytes of a patient with cutaneous T-cell lymphoma. Proc Natl Acad Sci U S A. 1980; 77(12): 7415-9.
3) Hinuma Y, et al. Adult T-cell leukemia: antigen in an ATL cell line and detection of antibodies to the antigen in human sera. Proc Natl Acad Sci U S A. 1981; 78(10): 6476-80.
4) Yoshida M, et al. Monoclonal integration of human T-cell leukemia provirus in all primary tumors of adult T-cell leukemia suggests causative role of human T-cell leukemia virus in the disease. Proc Natl Acad Sci U S A. 1984; 81(8): 2534-7.
5) Miyoshi I, et al. Type C virus particles in a cord T-cell line derived by co-cultivating normal human cord leukocytes and human leukaemic T-cells. Nature. 1981; 294(5843): 770-1.
6) Ohshima K, et al. Adult T-cell leukemia/lymphoma. Swerdlow SH, et al. eds. WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues. Lyon. IARC; 2017: pp363-7.
7) Iwanaga M. Epidemiology of HTLV-1 Infection and ATL in Japan: An Update. Front Microbiol. 2020; 11: 1124.
8) Nosaka K, et al. Epidemiological and clinical features of adult T-cell leukemia-lymphoma in Japan, 2010-2011: A nationwide survey. Cancer Sci. 2017; 108(12): 2478-86.
9) Shimoyama M, et al. Diagnostic criteria and classification clinical subtypes of adult T-cell leukemia-lymphoma. Br J Haematol. 1991; 79(3): 428-37.
10)Ito S, et al. Epidemiology of adult T-cell leukemia-lymphoma in Japan: An updated analysis, 2012-2013. Cancer Sci. 2021; 112(10): 4346-54.
11)Imaizumi Y, et al. Prognosis of patients with adult T-cell leukemia/lymphoma in Japan: A nationwide hospital-based study. Cancer Sci. 2020; 111(12): 4567-80.(3iiiA)
12)Katsuya H, et al. Prognostic index for acute- and lymphoma-type adult T-cell leukemia/lymphoma. J Clin Oncol. 2012; 30(14): 1635-40.
13)Fukushima T, et al. Japan Clinical Oncology Group(JCOG)prognostic index and characterization of long-term survivors of aggressive adult T-cell leukaemia-lymphoma(JCOG0902A). Br J Haematol. 2014; 166(5): 739-48.
14)Fuji S, et al. Development of a modified prognostic index for patients with aggressive adult T-cell leukemia-lymphoma aged 70 years or younger: possible risk-adapted management strategies including allogeneic transplantation. Haematologica. 2017; 102(7): 1258-65.(3iiiA)
アルゴリズム
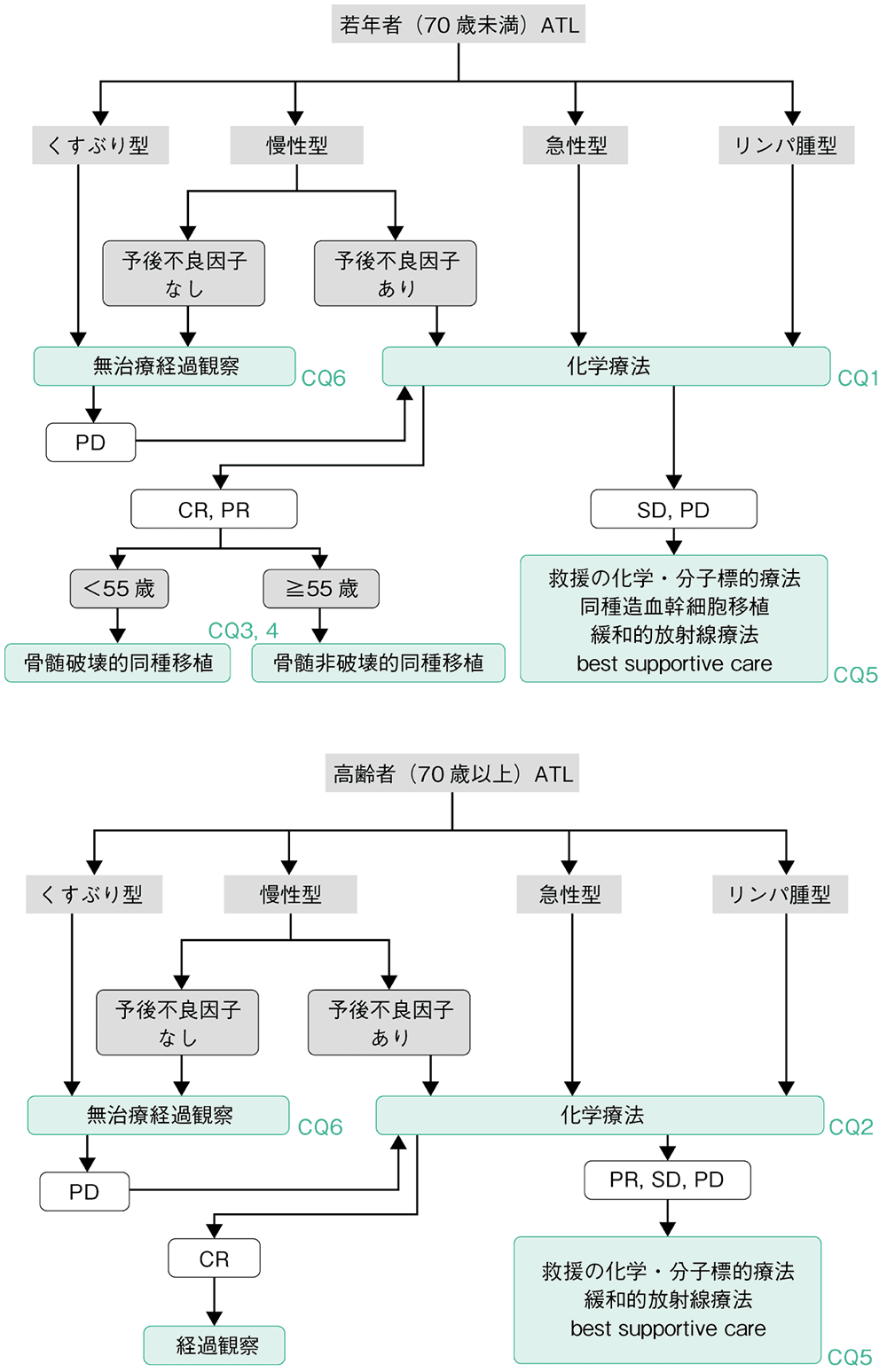
ATLのうち,急性型,リンパ腫型,予後不良因子(LDH高値,アルブミン低値,BUN高値)のいずれか1つ以上を有する慢性型は,アグレッシブATLと呼ばれ,多剤併用化学療法を施行する(CQ1,2)。同種造血幹細胞移植は一般的に70歳までが施行されることより,本アルゴリズムは70歳未満と70歳以上に分類して作成した。70歳未満の場合で,化学療法に治療反応性が認められ,全身状態や主要臓器機能が問題なければ,同種造血幹細胞移植を考慮する(CQ3)。HLA一致血縁ドナーや非血縁ドナーからの移植が第一であるが,適切なドナーが得られない場合は,臍帯血移植やHLA半合致移植も考慮される(CQ4)。再発・難治性ATLの場合は,化学療法や分子標的薬の使用が考慮される(CQ5)。予後不良因子を有していない慢性型,くすぶり型のインドレントATLに対しては,現時点では,早期治療介入の有用性を示す治療法はまだ明確ではなく,アグレッシブATLへ進展するまで無治療経過観察をする(CQ6)。
CQ1 初発若年者(70歳未満)アグレッシブATLに勧められる治療は何か
- 推奨グレード
- カテゴリー1
多剤併用化学療法(VCAP-AMP-VECP療法)が推奨される。モガムリズマブ併用については,初回治療に引き続き同種造血幹細胞移植が計画されている場合,移植後GVHDを増強させる可能性があり,慎重に考慮する必要がある。
解説
ATLに対する治療は,1980年代からさまざまなレジメンで臨床試験が行われているが,平均生存期間が1年未満であり,極めて予後不良であった1)。その後,JCOG-LSGより臨床病型分類が提唱され,治療適応となるアグレッシブATLにおいて継続して臨床試験が行われた2,3)。8種類の細胞障害性抗がん薬とG-CSF製剤を用いて治療強度を高め,メトトレキサート(MTX)とプレドニゾロン(PSL)を併用した髄注を用いる治療法(LSG15療法)でそれまでの治療成績より良好な結果が得られた4)。さらにコース数を短縮し髄注にシタラビン(AraC)を加えたVCAP-AMP-VECP(modified LSG15)療法[VCAP(VCR,CPA,DXR,PSL),AMP(DXR,MCNU,PSL),VECP(VDS,ETP,CBDCA,PSL)]と非ホジキンリンパ腫の治療法の一つであるCHOP-14療法(CPA,DXR,VCR,PSL)とのランダム化第Ⅲ相比較試験が行われ,血液毒性は高いもののCR割合,OSともにVCAP-AMP-VECP療法が優れている結果となり5),標準治療の一つと位置付けられた。
ATL細胞の90%以上で発現しているケモカイン受容体のCCR46)を標的とした抗CCR4抗体[モガムリズマブ(MOGA)]について,VCAP-AMP-VECP療法との併用療法とVCAP-AMP-VECP単独療法とのランダム化比較第Ⅱ相試験が行われ,併用療法はCR到達割合で優れていた7,8)。この結果よりMOGAは初発CCR4陽性ATL症例に適応拡大された。しかし,OS,PFSで有意差は得られていない。また,同種造血幹細胞移植の先行治療としてMOGAを使用する場合,GVHDの発症頻度,重症化の頻度,移植関連死亡割合の増加が報告されており9),移植前の使用については慎重に考慮する必要がある。
現時点で初発アグレッシブATLに対する唯一のランダム化第Ⅲ相比較試験の結果から,VCAP-AMP-VECP療法が推奨される。ただし,臨床試験の対象年齢,およびその後の後方視的解析の結果10)から70歳未満に適用される。
ブレンツキシマブ ベドチン(BV)は抗CD30抗体にmonomethyl auristatin Eが結合している薬剤で,未治療CD30陽性末梢性T細胞リンパ腫に対するBV-CHP療法(BV,CPA,DXR,PSL)とCHOP療法の比較試験で有用性が確認され11),保険承認された。CD30陽性の初発アグレッシブATLに使用可能であるが,ATLは少数例の登録であり,有効性についてはさらに評価が必要である。
参考文献
1) Shimoyama M, et al. Chemotherapeutic results and prognostic factors of patients with advanced non-Hodgkin’s lymphoma treated with VEPA or VEPA-M. J Clin Oncol. 1988; 6(1): 128-41.(1iiDiv)
2) Shimoyama M, et al. Major prognostic factors of adult patients with advanced T-cell lymphoma/leukemia. J Clin Oncol 1988; 6(7): 1088-97.(2A)
3) Tsukasaki K, et al. Deoxycoformycin-containing combination chemotherapy for adult T-cell leukemia-lymphoma: Japan Clinical Oncology Group Study(JCOG9109). Int J Hematol. 2003; 77(2): 164-70.(3iiiDiv)
4) Yamada Y, et al. A new G-CSF-supported combination chemotherapy, LSG15, for adult T-cell leukaemia-lymphoma: Japan Clinical Oncology Group Study 9303. Br J Haematol. 2001; 113(2): 375-82.(3iiiA)
5) Tsukasaki K, et al. VCAP-AMP-VECP compared with biweekly CHOP for adult T-cell leukemia-lymphoma: Japan Clinical Oncology Group Study JCOG9801. J Clin Oncol. 2007; 25(34): 5458-64.(1iiA)
6) Ishida T, et al. Clinical significance of CCR4 expression in adult T-cell leukemia/lymphoma: its close association: with skin involvement and unfavorable outcome. Clin Cancer Res. 2003; 9(10Pt1): 3625-34.(3iiiA)
7) Ishida T, et al. Dose-intensified chemotherapy alone or in combination with mogamulizumab in newly diagnosed aggressive adult T-cell leukaemia-lymphoma: a randomized phase II study. Br J Haematol. 2015; 169(5): 672-82.(3iiiDiv)
8) Ishida T, et al. Follow-up of a randomised phase II study of chemotherapy alone or in combination with mogamulizumab in newly diagnosed aggressive adult T-cell leukaemia-lymphoma: impact on allogeneic haematopoietic stem cell transplantation. Br J Haematol. 2019; 184(3): 479-83.(3iiiDiv)
9) Fuji S, et al. Pretransplantation Anti-CCR4 Antibody Mogamulizumab Against Adult T-Cell Leukemia/Lymphoma Is Associated With Significantly Increased Risks of Sever and Corticosteroid-Refractory Graft-Versus-Host Disease, Nonrelapse Mortality, and Overall Mortality. J Clin Oncol. 2016; 34(28): 3426-33.(3iiiA)
10)Fuji S, et al. VCAP-AMP-VECP as a preferable induction chemotherapy in transplant-eligible patients with aggressive adult T-cell leukemia-lymphoma: a propensity score analysis. Bone Marrow Transplant. 2019; 54(9): 1399-405.(3iiiA)
11)Horwitz S, et al. Brentuximab vedotin with chemotherapy for CD30-positive peripheral T-cell lymphoma(ECHELON-2): a global, double-blind, randomised, phase 3 trial. Lancet. 2019; 393(10168): 229-40.(1iDiii)
CQ2 初発高齢者(70歳以上)アグレッシブATLに対してどのような治療が勧められるか
- 推奨グレード
- カテゴリー2B
全身状態が比較的良好な高齢者では若年者と同様の治療を行うが,治療強度の減弱が必要である。
解説
高齢者だけを対象とした初発アグレッシブATLに対する前方視的臨床試験は行われていない。アグレッシブATLに対する唯一のランダム化第Ⅲ相比較試験であるJCOG9801でVCAP-AMPVECP療法[VCAP(VCR,CPA,DXR,PSL),AMP(DXR,MCNU,PSL),VECP(VDS,ETP,CBDCA,PSL)]が標準治療として位置付けられたが,70歳未満を対象としており,さらにサブグループ解析で56歳以上ではCHOP-14療法(CPA,DXR,VCR,PSL)との間でOSに有意差は認められなかった1)。単施設での70歳以上のアグレッシブATL 34例に対する減量VCAP-AMPVECP療法に関する後方視的解析で,MSTが13.4カ月と高齢者の治療選択肢となることが示された2)。モガムリズマブ(MOGA)併用VCAP-AMP-VECP療法とVCAP-AMP-VECP療法単独とのランダム化第Ⅱ相比較試験は,70歳以上の患者が含まれており,併用療法がCR割合で優れていることを示したが,有害事象が多かった3)。また,追跡調査でOS,PFSで両群に差はみられておらず,MOGAの上乗せ効果については結論が出ていない4)。
その他にTHP-COP療法(CPA,THP-DXR,VCR,PSL)5),modified EPOCH療法(ETP,DXR,CPA,VCR,PSL)6)について70歳以上の高齢者を含んだ第Ⅱ相試験が行われ,いずれも治療選択肢となることが示されたが,多くで減量を必要とした。2010~2011年に発症したアグレッシブATLの全国予後調査で,全770例中70歳以上で化学療法を受けた急性型145例では,CHOP類似療法,次いでVCAP-AMP-VECP類似療法が選択されていた7)。
高齢者アグレッシブATLでは若年者と同様の治療により治療反応性が期待されるが,年齢,臓器機能を考慮して治療強度を弱める必要がある。
参考文献
1) Tsukasaki K, et al. VCAP-AMP-VECP compared with biweekly CHOP for adult T-cell leukemia-lymphoma: Japan Clinical Oncology Group Study JCOG9801. J Clin Oncol. 2007; 25(34): 5458-64.(1iiA)
2) Makiyama J, et al. Treatment outcome of elderly patients with aggressive adult T cell leukemia-lymphoma: Nagasaki University Hospital experience. Int J Hematol. 2014; 100(5): 464-72.(3iiA)
3) Ishida T, et al. Dose-intensified chemotherapy alone or in combination with mogamulizumab in newly diagnosed aggressive adult T-cell leukaemia-lymphoma: a randomized phase II study. Br J Haematol. 2015; 169(5): 672-82.(3iiiDiv)
4) Ishida T, et al. Follow-up of a randomised phase II study of chemotherapy alone or in combination with mogamulizumab in newly diagnosed aggressive adult T-cell leukaemia-lymphoma: impact on allogeneic haematopoietic stem cell transplantation. Br J Haematol. 2019; 184(3): 479-83.(3iiiDiii)
5) Takamatsu Y, et al. THP-COP regimen for the treatment of peripheral T-cell lymphoma and adult T-cell leukemia/lymphoma: a multicenter phase II study. Eur J Haematol. 2010; 84(5): 391-7.(3iiiDiv)
6) Tsukamoto Y, et al. Efficacy and Safety of the Modified EPOCH Regimen(Etoposide, Vincristine, Doxorubicin, Carboplatin, and Prednisolone)for Adult T-cell Leukemia/Lymphoma: A Multicenter Retrospective Study. Clin Lymphoma Myeloma Leuk. 2020; 20(7): e445-53.(3iiiDiv)
7) Imaizumi Y, et al. Prognosis of patients with adult T-cell leukemia/lymphoma in Japan: A nationwide hospital-based study. Cancer Sci. 2020; 111(12): 4567-80.(3iiiA)
CQ3 アグレッシブATLに対して同種造血幹細胞移植は勧められるか
- 推奨グレード
- カテゴリー2A
アグレッシブATLで治療反応性がある症例に関しては,同種造血幹細胞移植は長期生存が期待できる治療法として推奨される。
解説
アグレッシブATLに対する同種造血幹細胞移植(同種移植)は,1990年代から積極的に施行され有望な成績が報告された1-4)。そして大規模な日本のデータベースをもとにした後方視的調査で,同種移植を施行されたATL 386例の3年OSが33%と報告された5)。また,前方視的観察研究の結果においても,同様の成績が報告されている6)。2010~2011年発症のATLに対する全国予後調査において,同種移植を行った症例数は限定的であったものの,化学療法単独での治療成績と比較して有望な治療成績であり7),化学療法では得られないATLクローンが消失したと考えられる症例も報告されている8)。以上から,移植関連死亡割合が高いものの,前治療で反応が得られている例9,10)では同種移植は推奨される。治療効果に関して,ドナー由来免疫担当細胞による免疫学的機序の関与が示唆されている11)。
同種移植の前処置法に関する大規模な後方視的解析で,骨髄破壊的前処置と骨髄非破壊的前処置との間にOSや再発割合に差は認めないことが報告された12-16)。現在では,骨髄破壊的前処置の対象年齢上限は55歳とし,骨髄非破壊的前処置は50~70歳を対象とすることが一般的である。
ドナー選択については,HLA一致血縁・非血縁ドナーが第一選択となる5)。臍帯血については,先の大規模後方視的解析で予後不良因子の一つであったが5),その後,実施可能性を示す後方視的解析結果が報告されている6,17,18)。ただし,HLA一致血縁・非血縁ドナーによる成績を上回るものではなく,慎重に選択することが望ましい。血縁HTLV-1キャリアドナーからの同種移植で,ドナーHTLV-1感染細胞由来の再発例が報告されており19),血縁HTLV-1キャリアをドナーとする場合には,リンパ節腫脹,異常リンパ球の出現がないなど臨床的にATLを発症していないことを確認することが推奨され,保険適用外検査ではあるが,末梢血のHTLV-1サザンブロット解析などでモノクローナルあるいはオリゴクローナルなHTLV-1感染細胞が検出されないことを確認することも望まれる20)。
移植前に実施する治療としてのモガムリズマブ(MOGA)投与は,移植関連死亡が増加し,移植成績が低下することが報告されており,移植の実施を検討している場合,移植前のMOGA投与については十分に注意する必要がある21)。
参考文献
1) Utsunomiya A, et al. Improved outcome of adult T-cell leukemia/lymphoma with allogeneic hematopoietic stem cell transplantation. Bone Marrow Transplant. 2001; 27(1): 15-20.(3iiiA)
2) Kami M, et al. Allogeneic haematopoietic stem cell transplantation for the treatment of adult T-cell leukemia/ lymphoma. Br J Haematol. 2003; 120(2): 304-9.(3iiiA)
3) Kato K, et al. Allogeneic bone marrow transplantation from unrelated human T-cell leukemia virus-I-negative donors for adult T-cell leukemia/lymphoma: retrospective analysis of data from the Japan Marrow Donor Program. Biol Blood Marrow Transplant. 2007; 13(1): 90-9.(3iiiA)
4) Fukushima T, et al. Allogeneic hematopoietic stem cell transplantation provides sustained long-term survival for patients with adult T-cell leukemia/lymphoma. Leukemia. 2005; 19(5): 829-34.(3iiiA)
5) Hishizawa M, et al. Transplantation of allogeneic hematopoietic stem cells for adult T-cell leukemia: a nationwide retrospective study. Blood. 2010; 116(8): 1369-76.(3iiiA)
6) Ito A, et al. Improved survival of patients with aggressive ATL by increased use of allo-HCT: a prospective observational study. Blood Adv. 2021; 5(20): 4156-66.(3iiiA)
7) Imaizumi Y, et al. Prognosis of patients with adult T-cell leukemia/lymphoma in Japan: A nationwide hospital-based study. Cancer Sci. 2020; 111(12): 4567-80.(3iiiA)
8) Yamasaki R, et al. Small number of HTLV-1-positive cells frequently remains during complete remission after allogeneic hematopoietic stem cell transplantation that are heterogeneous in origin among cases with adult T-cell leukemia/lymphoma. Leukemia. 2007; 21(6): 1212-7.
9) Inoue Y, et al. Prognostic importance of pretransplant disease status for posttransplant outcomes in patients with adult T cell leukemia/lymphoma. Bone Marrow Transplant. 2018; 53(9): 1105-15.(3iiiA)
10)Fuji S, et al. Early application of related SCT might improve clinical outcome in adult T-cell leukemia/lymphoma. Bone Marrow Transplant. 2016; 51(2): 205-11.(3iiiA)
11)Kanda J, et al. Impact of graft-versus-host disease on outcome after allogeneic hematopoietic cell transplantation for adult T-cell leukemia: a retrospective cohort study. Blood. 2012; 119(9): 2141-8.(3iiiA)
12)Ishida T, et al. Allogeneic hematopoietic stem cell transplantation for adult T-cell leukemia-lymphoma with special emphasis on preconditioning regimen: a nationwide retrospective study. Blood. 2012; 120(8): 1734-41.(3iiiA)
13)Okamura J, et al. Allogeneic stem-cell transplantation with reduced conditioning intensity as a novel immunotherapy and antiviral therapy for adult T-cell leukemia/lymphoma. Blood. 2005; 105(10): 4143-5.(2A)
14)Tanosaki R, et al. Allogeneic hematopoietic stem cell transplantation using reduced-intensity conditioning for adult T-cell leukemia/lymphoma: impact of antithymocyte globulin on clinical outcome. Biol Blood Marrow Transplant. 2008; 14(6): 702-8.(3iiiA)
15)Choi I, et al. Long-term outcome after hematopoietic SCT for adult T-cell leukemia/lymphoma: results of prospective trials. Bone Marrow Transplant. 2011; 46(1): 116-8.(3iiiA)
16)Inoue Y, et al. Impact of conditioning intensity and regimen on transplant outcomes in patients with adult T-cell leukemia-lymphoma. Bone Marrow Transplant. 2021; 56(12): 2964-74.(3iiiA)
17)Muranushi H, et al. GVHD-free, relapse-free survival provides novel clues for optimizing allogeneic-HSCT for adult T-cell leukemia/lymphoma. Bone Marrow Transplant. 2021; 56(1): 155-66.(3iiiA)
18)Fuji S, et al. A decision analysis comparing unrelated bone marrow transplantation and cord blood transplantation in patients with aggressive adult T-cell leukemia-lymphoma. Int J Hematol. 2020; 111(3): 427-33.(3iiiA)
19)Tamaki H, et al. Donor-derived T-cell leukemia after bone marrow transplantation. N Engl J Med. 2006; 354(16): 1758-9.
20)血縁造血幹細胞(骨髄・末梢血)ドナー傷害保険加入適格基準(2015.8, Version 2.2), 日本造血幹細胞移植学会 ドナー委員会.
21)Fuji S, et al. Pretransplantation Anti-CCR4 Antibody Mogamulizumab Against Adult T-Cell Leukemia/Lymphoma Is Associated With Significantly Increased Risks of Severe and Corticosteroid-Refractory Graft-Versus-Host Disease, Nonrelapse Mortality, and Overall Mortality. J Clin Oncol. 2016; 34(28): 3426-33.(3iiiA)
CQ4 アグレッシブATLに対する同種造血幹細胞移植において臍帯血移植やHLA半合致移植は有用か
- 推奨グレード
- カテゴリー2B
血縁ドナー,非血縁ドナーの適格ドナー確保が困難な場合には,臍帯血移植やHLA半合致移植を考慮する。
解説
アグレッシブATLで治療反応性のある症例には同種造血幹細胞移植が考慮されるが,血縁ドナーや骨髄バンクからのドナーを第一選択として行われている。しかし,血縁ドナー候補者の高齢化や骨髄バンクドナーのコーディネートに時間を要することなどから,移植到達前に治療不応性となる場合もある。そこで,臍帯血移植やHLA半合致移植が試みられ,いくつかの後方視的な報告がなされている。1990年代後半から2000年代前半までの大規模なデータベースをもとにした後方視的解析では,臍帯血移植の3年OSで17%と血縁間移植および非血縁間移植に比べ劣っており,治療関連死亡割合も多かった1)。その後,移植時の病勢コントロールが良好な場合は治療成績が改善するとの報告がある2-6)。さらに,非GVHD非再発全生存割合では,血縁ドナーや非血縁ドナーと比べても差が認められないと報告されている7)。また,最近の移植の状態を検討した前方視的コホート解析では,2年OSやNRMについて,臍帯血移植やHLA半合致移植は,血縁ドナーや非血縁ドナーからの移植と有意差がなかったと報告されている8)。GVHD予防にシクロホスファミドを使用したHLA半合致移植の第Ⅰ/Ⅱ相試験においては,その忍容性と有効性が報告された9)。
以上より,HLA一致血縁・非血縁ドナーが第一選択であるが,HLA一致血縁ドナー・非血縁ドナーの適格ドナー確保が困難な場合,臍帯血移植やHLA半合致移植を考慮する。
参考文献
1) Hishizawa M, et al. Transplantation of allogeneic hematopoietic stem cells for adult T-cell leukemia: a nationwide retrospective study. Blood. 2010; 116(8): 1369-76.(3iiiA)
2) Fukushima T, et al. Feasibility of cord blood transplantation in chemosensitive adult T-cell leukemia/ lymphoma: a retrospective analysis of the Nagasaki Transplantation Network. Int J Hematol. 2013; 97(4): 485-90.(3iiiA)
3) Kato K, et al. Treatment of patients with adult T-cell leukemia/lymphoma with cord blood transplantation: a Japanese nationwide retrospective survey. Biol Blood Marrow Transplant. 2014; 20(12): 1968-74.(3iiiA)
4) Nakamura T, et al. Unrelated cord blood transplantation for patients with adult T-cell leukemia/lymphoma: experience at a single institute. Int J Hematol. 2012; 96(5): 657-63.(3iiiA)
5) Nakano N, et al. Cord blood transplantation with a reduced-intensity conditioning regimen using fludarabine and melphalan for adult T-cell leukemia/lymphoma. Int J Hematol. 2021; 113(6): 861-71.(3iiiA)
6) Yoshimitsu M, et al. A retrospective analysis of haplo-identical HLA-mismatch hematopoietic transplantation without posttransplantation cyclophosphamide for GVHD prophylaxis in patients with adult T-cell leukemia-lymphoma. Bone Marrow Transplant. 2019; 54(8): 1266-74.(3iiiA)
7) Muranushi H, et al. GVHD-free, relapse-free survival provides novel clues for optimizing allogeneic-HSCT for adult T-cell leukemia/lymphoma. Bone Marrow Transplant. 2021; 56(1): 155-66.(3iiiA)
8) Ito A, et al. Improved survival of patients with aggressive ATL by increased use of allo-HCT: a prospective observational study. Blood Adv. 2021; 5(20): 4156-66.(3iiiA)
9) Tanaka T, et al. A Phase I/II Multicenter Trial of HLA-Haploidentical PBSCT with PTCy for Aggressive Adult T Cell Leukemia/Lymphoma. Transplant Cell Ther. 2021; 27(11): 928.e1-7.(3iiiDiv)
CQ5 再発・難治性ATLに勧められる治療は何か
- 推奨グレード
- カテゴリー2B
化学療法や分子標的薬が選択肢として考えられ,治療反応性が良い場合は同種造血幹細胞移植も考慮される。
解説
アグレッシブATLの再発・難治例に対して,これまでにさまざまなレジメンが開発されてきた。いずれの報告も一過性の治療効果はあるものの持続期間は短い。本邦では,EPOCH療法(ETP,PSL,VCR,CPA,DXR),ソブゾキサン(MST-16),イリノテカンなどの小規模の第Ⅱ相臨床試験が報告されている。全奏効割合(ORR)は38~57%であるが,効果持続期間は1~6カ月である1-3)。その後,2012年以降いくつかの新規薬剤の臨床試験が行われている。抗CCR4抗体であるモガムリズマブ(MOGA)は,ORRが第Ⅰ相試験で31%,第Ⅱ相試験で50%であり,第Ⅱ相試験での全生存割合の中央値(median OS)は13.7カ月であった4,5)。長期フォローアップの報告では,第Ⅰ相試験での31%の症例が3年以上の生存,第Ⅱ相試験での3年OSが23%と報告された6)。免疫賦活剤であるレナリドミド(LEN)は,第Ⅰ相試験で33%,第Ⅱ相試験で42%のORRであり,第Ⅱ相試験でのmedian OSは20.3カ月と報告された7,8)。経口ヒストン脱アセチル化酵素阻害剤であるツシジノスタットは,MOGAの前治療歴のある再発・難治性ATLを対象に行われた第Ⅱ相試験において30%のORR,median OSは7.9カ月であったと報告された9)。また,ヒストンメチル化酵素であるEZH1/2阻害薬であるバレメトスタットは,MOGAの前治療歴のある再発・難治性ATLを対象に行われた第Ⅱ相試験において,48%のORR,median OSは16.4カ月であった10)。これら4薬剤については,現在(2023年6月),再発・難治性ATLに対して本邦で保険承認されている(MOGAは未治療ATLに対しても保険承認されている)。抗CD30抗体薬物複合体であるブレンツキシマブ ベドチン(BV)は,CD30陽性の再発・難治性PTCLに対する第Ⅱ相試験で有効性が報告され,CD30陽性再発・難治性ATLに対して使用可能となっている11)。同種造血幹細胞移植が化学療法後の再発・難治性のアグレッシブATLの治療反応性の良い場合に対して長期生存をもたらすことが複数の報告で示されている12,13)。同種移植後の再発ATLは非常に予後不良であるが,ドナーリンパ球輸注の有効性が示唆されている14)。その他,放射線療法は,化学療法に抵抗性のATL関連局所病変を良好にコントロールすることができたという報告もあり,局所制御,症状緩和を目的とする場合に考慮される15,16)。
参考文献
1) Toriyama E, et al. EPOCH regimen as salvage therapy for adult T-cell leukemia-lymphoma. Int J Hematol. 2018; 108(2): 167-75.(3iiiA)
2) Ohno R, et al. Treatment of adult T-cell leukemia/lymphoma with MST-16, a new oral antitumor drug and a derivative of bis(2,6-dioxopiperazine). The MST-16 Study Group. Cancer. 1993; 71(7): 2217-21.(3iiiDiv)
3) Tsuda H, et al. Treatment of adult T-cell leukaemia-lymphoma with irinotecan hydrochloride(CPT-11). CPT-11 Study Group on Hematological Malignancy. Br J Cancer. 1994; 70(4): 771-4.(3iiiDiv)
4) Yamamoto K, et al. Phase Ⅰ study of KW-0761, a defucosylated humanized anti-CCR4 antibody, in relapsed patients with adult T-cell leukemia-lymphoma and peripheral T-cell lymphoma. J Clin Oncol. 2010; 28(9): 1591-8.(3iiiDiv)
5) Ishida T, et al. Defucosylated anti-CCR4 monoclonal antibody(KW-0761)for relapsed adult T-cell leukemia-lymphoma: a multicenter phase II study. J Clin Oncol. 2012; 30(8): 837-42.(3iiiDiv)
6) Ishida T, et al. Mogamulizumab for relapsed adult T-cell leukemia-lymphoma: Updated follow-up analysis of phase Ⅰ and Ⅱ studies. Cancer Sci. 2017; 108(10): 2022-9.(3iiiDiv)
7) Ogura M, et al. Lenalidomide in relapsed adult T-cell leukaemia-lymphoma or peripheral T-cell lymphoma(ATLL-001): a phase 1, multicentre, dose-escalation study. Lancet Haematol. 2016; 3(3): e107-18(3iiiDiv)
8) Ishida T, et al. Multicenter Phase Ⅱ Study of Lenalidomide in Relapsed or Recurrent Adult T-cell Leukemia/Lymphoma: ATLL-002. J Clin Oncol. 2016; 34(34): 4086-93.(3iiiDiv)
9) Utsunomiya A, et al. Oral histone deacetylase inhibitor tucidinostat(HBI-8000)in patients with relapsed or refractory adult T-cell leukemia/lymphoma: Phase IIb results. Cancer Sci. 2022; 113(8): 2778-87.(3iiiDiv)
10)Izutsu K, et al. An Oral-Level, Single-Arm, Phase 2 trail of Valemetostat in Relapsed or Refractory Adult T-cell Leukemia/Lymphoma. Blood. 2023; 141(9): 1159-68.(3iiiDiv)
11)Horwitz S, et al. Brentuximab vedotin with chemotherapy for CD30-positive peripheral T-cell lymphoma(ECHELON-2): a global, double-blind, randomised, phase 3 trial. Lancet. 2019; 393(10168): 229-40.(1iDiii)
12)Fukushima T, et al. Allogeneic hematopoietic stem cell transplantation provides sustained long-term survival for patients with adult T-cell leukemia/lymphoma. Leukemia. 2005; 19(5): 829-34.(3iiiA)
13)Kato K, et al. Allogeneic bone marrow transplantation from unrelated human T-cell leukemia virus-I-negative donors for adult T-cell leukemia/lymphoma: retrospective analysis of data from the Japan Marrow Donor Program. Biol Blood Marrow Transplant. 2007; 13(1): 90-9.(3iiiA)
14)Kato K, et al. The outcome and characteristics of patients with relapsed adult T cell leukemia/lymphoma after allogeneic hematopoietic stem cell transplantation. Hematol Oncol. 2019; 37(1): 54-61.(3iiiA)
15)Simone CB 2nd, et al. Radiation therapy for the management of patients with HTLV-1-associated adult T-cell leukemia/lymphoma. Blood. 2012; 120(9): 1816-9.(3iiiDiv)
16)Maemoto H, et al. Appropriate radiation dose for symptomatic relief and local control in patients with adult T cell leukemia/lymphoma. J Radiat Res. 2019; 60(1): 98-108.(3iiiDiv)
CQ6 インドレントATLに対する早期治療介入は有用か
- 推奨グレード
- 該当なし
インドレントATLに対する早期治療介入は推奨しない。
解説
九州および沖縄の40施設におけるくすぶり型および慢性型ATL 337例を対象とした後方視的解析で1),MSTはそれぞれ5.2年と3.6年であった。サブグループ解析では,くすぶり型での無治療群と抗がん薬投与群との間でOSに差はなく,慢性型では無治療群の方が抗がん薬投与群よりも有意にOSが長かった(MST 7.4年vs. 2.0年)。1988~1997年に九州の多施設でくすぶり型ATLと診断された26例のMSTは7.3年(観察期間中央値6.5年)であった2)。単施設での後方視的研究報告で,1974~2003年にくすぶり型(25例),慢性型(予後不良因子を持つ慢性型37例,予後不良因子を持たない慢性型26例,不明2例)と診断され,増悪するまで無治療経過観察が行われた計90例では,観察期間中央値が4.1年の時点で12例が10年以上生存していた。しかし,2年,5年,10年,15年OSはそれぞれ約60%,47%,23%,13%と長期予後は不良であった3)。MSTと無増悪MSTはそれぞれ4.1年と3.3年であり,増悪後のMSTは約1年と推定され,長期生存例が一定の割合で存在するものの,増悪後の予後は不良であった。
2000~2009年のインドレントATL(くすぶり型,慢性型)248例の後方視的な解析で,sIL2Rを予後因子として高リスク群,中間リスク群,低リスク群の3群に分類したところ,MSTはそれぞれ1.6年,5.5年,未到達で,高リスクの場合は,予後が不良であることが示された4)。
以上のように,インドレントATLの長期予後は決して良好ではない。しかし,有効な治療法がまだ見出されていないため,急性転化まで無治療で経過観察することが,わが国では現在のコンセンサスとして定着している。
また,くすぶり型で皮膚病変のみを持つ症例の局所治療は,皮膚悪性腫瘍診療ガイドライン5),および皮膚病変を有するATL患者を血液内科医と皮膚科医が併診する場合のガイドライン解説書の参照が推奨される6)。皮膚病変を有するインドレントATLの多くが長期生存するが,腫瘤性などの皮膚病変を有するインドレントATLは予後不良であるとの報告が複数ある。皮膚原発の節外性リンパ腫型ATLのカテゴリーが提唱されているが,その皮膚病変の性状の定義などは未確立である7)。
参考文献
1) 山田恭暉ほか.悪性リンパ腫の治療戦略 高悪性度リンパ腫(成人T細胞白血病).臨床血液.2001; 42(4): 293-8.(3iiiA)
2) Ishitsuka K, et al. Smoldering adult T-cell leukemia-lymphoma: a follow-up study in Kyushu. Br J Haematol. 2008; 143(3): 442-4.(3iiiA)
3) Takasaki Y, et al. Long-term study of indolent adult T-cell leukemia-lymphoma. Blood. 2010; 115(22): 4337-43.(3iiiA)
4) Katsuya H, et al. Prognostic index for chronic- and smoldering-type adult T-cell leukemia-lymphoma. Blood. 2017; 130(1): 39-47.
5) 大塚幹夫ほか.皮膚悪性腫瘍診療ガイドライン第3 版 皮膚リンパ腫診療ガイドライン2020.日皮会誌.2020; 130(6): 1347-423.(ガイドライン)
6) 石田高司ほか.血液内科医・皮膚科医のための統合ATL 診療ガイドライン解説書2014.日皮会誌.2014; 124(12): 2275-9.
7) Tsukasaki K, et al. Meeting report on the possible proposal of an extranodal primary cutaneous variant in the lymphoma type of adult T-cell leukemia-lymphoma. J Dermatol. 2014; 41(1): 26-8.(3iiiDiv)

