第Ⅱ章 リンパ腫
Ⅱ リンパ腫
10 ホジキンリンパ腫
(Hodgkin lymphoma:HL)
総論
ホジキンリンパ腫(Hodgkin lymphoma:HL)は,欧米では悪性リンパ腫の約10,30%を占める。わが国での頻度は,全悪性リンパ腫の3~6%程度である。
年齢分布は,若年者層(20歳代)と中年層(50~60歳)にピークを有する二峰性を呈する。
初発症状は多くは無症候性,無痛性表在リンパ節腫脹で,約75%が頸部・鎖骨上窩リンパ節腫脹で発見される。結節硬化型HLは約60%に縦隔病変を認める。
血液検査所見は,白血球増多,リンパ球減少,好酸球増多,貧血,アルカリフォスファターゼ上昇,血液沈降速度亢進,CRP高値,細胞性免疫能低下などを認める。
病理組織学的には,Hodgkin/Reed-Sternberg(HRS)細胞,lymphocyte predominant(LP)細胞(popcorn細胞)などの腫瘍細胞の増生を特徴とするリンパ腫である。WHO分類(2017)においてHLは結節性リンパ球優位型HL(nodular lymphocyte predominant Hodgkin lymphoma:NLPHL)と古典的HL(classical Hodgkin lymphoma:CHL)の2つに大別されている1,2)。HRS細胞はCHL,LP細胞はNLPHLに特徴的とされる。CHLは結節硬化型CHL(nodular sclerosis classical Hodgkin lymphoma),リンパ球豊富型CHL(lymphocyte-rich classical Hodgkin lymphoma),混合細胞型CHL(mixed cellularity classical Hodgkin lymphoma),リンパ球減少型CHL(lymphocyte depleted classical Hodgkin lymphoma)の4つの準疾患単位に分類される。
HLはAnn Arbor病期分類によりⅠ~Ⅳ期に分類される。
1.限局期CHLの予後因子
限局期(Ⅰ,Ⅱ期)CHLの予後因子を表1に示す。研究グループにより重視する予後因子が異なることに注意が必要である3-5)。
表1 各研究グループによる限局期CHLの予後因子
| 研究グループ | GHSG | EORTC | NCIC/ECOG | NCCN2023 |
|---|---|---|---|---|
| 予後良好群 |
病期Ⅰ,Ⅱ期 リスク因子なし |
病期Ⅰ,Ⅱ期 (横隔膜上部病変) リスク因子なし |
病期Ⅰ,ⅡA期 リスク因子なし |
病期Ⅰ,Ⅱ期 リスク因子なし |
| 予後不良群 |
病期Ⅰ,Ⅱ期 リスク因子あり 病期ⅡB期ではbulky縦隔病変,節外病変があれば進行期 |
病期Ⅰ,Ⅱ期 (横隔膜上部病変) リスク因子あり |
病期Ⅰ,ⅡA期 リスク因子あり ただし,bulky病変,腹腔内病変があると進行期 |
病期Ⅰ,Ⅱ期 リスク因子あり |
| リスク因子 |
1.縦隔病変(胸郭横径比 ≧1/3) 2.節外病変 3.血沈亢進(A≧50,B≧30) 4.3カ所以上リンパ節領域 |
1.縦隔病変(胸郭横径比≧0.35) 2.50歳以上 3.血沈亢進(A≧50,B≧30) 4.4カ所以上リンパ節領域 |
1.40歳以上 2.血沈亢進(≧50) 3.4カ所以上リンパ節領域 4.混合細胞型あるいはリンパ球減少型古典的Hodgkinリンパ腫 |
1.縦隔病変(胸郭横径比>0.33) 2.血沈亢進(≧50) 3.B症状 4.4カ所以上リンパ節領域 5.10 cmを超える病変 |
GHSG:German Hodgkin Study Group, EORTC:European Organization for Research and Treatment of Cancer, NCIC:National Cancer Institute of Canada, ECOG:Eastern Cooperative Oncology Group, NCCN:National Comprehensive Cancer Network
(文献3-5)より引用)
2.進行期CHLの予後因子
進行期CHL(Ⅲ,Ⅳ期)に用いられる予後予測モデルとしてはInternational Prognostic Score(IPS)がある6)。これは15~65歳の進行期CHLでMOPP療法[mechlorethamine(国内未承認),VCR,PCZ,PSL]やABVD療法(DXR,BLM,VBL,DTIC)などによる治療を受けた4,695例を対象とし解析を行い,無増悪期間(TTP)をエンドポイントとして7つの予後因子を抽出した。これらの因子の数によって無増悪期間の予測が可能とされている。このシステムでは5年での予測無増悪期間は,予後不良因子数0の場合は84%であるのに対し,5以上の場合は42%と不良である。
参考文献
1) Stein H, et al. Hodgkin lymphomas. Swerdlow SH, et al. eds. WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues. Lyon, IARC; 2017: pp424-42.
2) Nogová L, et al. Lymphocyte-predominant and classical Hodgkin’s lymphoma: a comprehensive analysis from the German Hodgkin Study Group. J Clin Oncol. 2008; 26(3): 434-9.(3iiiDiii)
3) Noordijk EM, et al. Combined-modality therapy for clinical stage I or II Hodgkin’s lymphoma: long-term results of the European Organisation for Research and Treatment of Cancer H7 randomized controlled trials. J Clin Oncol. 2006; 24(19): 3128-35.(1iiA)
4) Engert A, et al.; German Hodgkin’s Lymphoma Study Group. Involved-field radiotherapy is equally effective and less toxic compared with extended-field radiotherapy after four cycles of chemotherapy in patients with early-stage unfavorable Hodgkin’s lymphoma: results of the HD8 trial of the German Hodgkin’s Lymphoma Study Group. J Clin Oncol. 2003; 21(19): 3601-8.(1iiDiii)
5) Meyer RM, et al.; National Cancer Institute of Canada Clinical Trials Group, et al. Randomized comparison of ABVD chemotherapy with a strategy that includes radiation therapy in patients with limited-stage Hodgkin’s lymphoma: National Cancer Institute of Canada Clinical Trials Group and the Eastern Cooperative Oncology Group. J Clin Oncol. 2005; 23(21): 4634-42.(1iiDiii)
6) Hasenclever D, et al. A prognostic score for advanced Hodgkin’s disease. International Prognostic Factors Project on Advanced Hodgkin’s Disease. N Engl J Med. 1998; 339(21): 1506-14.(3iiiDiii)
アルゴリズム
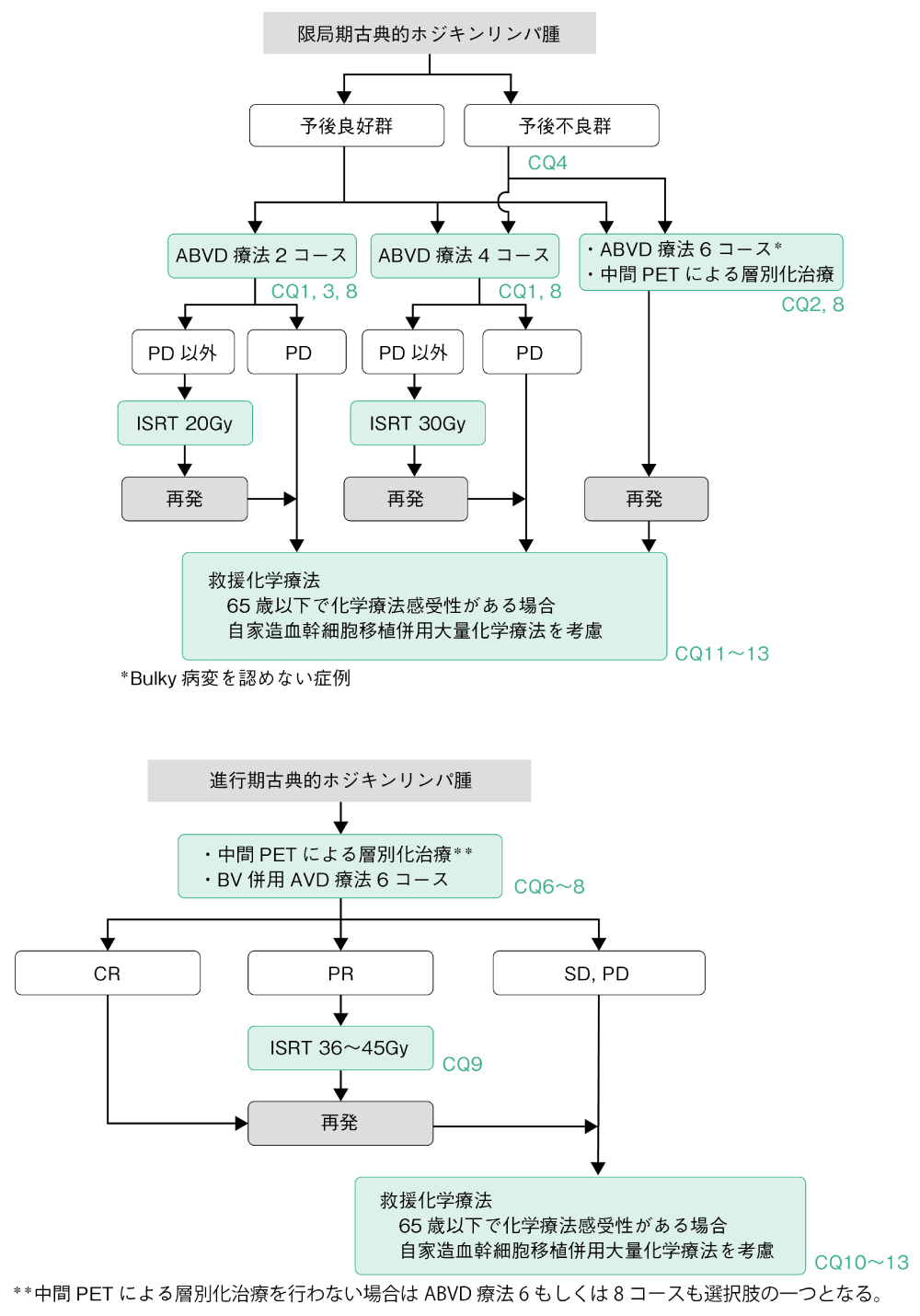
HLの治療法はCHLとNLPHLとで異なる。CHLにおいては限局期および進行期とも放射線療法単独で治療することは推奨されない。化学療法単独または化学療法と放射線療法の併用が推奨される。NLPHLのうち,限局期例ではinvolved-site radiotherapy(ISRT)が標準治療である(CQ5)。
化学療法はABVD療法(DXR,BLM,VBL,DTIC)が標準である。最近,進行期CHLに対しCD30を標的とする抗体薬剤複合体であるブレンツキシマブ ベドチン(BV)併用AVD療法(DXR,VBL,DTIC)が治療選択肢に加わった。
また,拡大放射線療法(extended field radiation therapy:EFRT)であるマントル照射,亜全リンパ領域照射,全リンパ領域照射などに代表される系統的なリンパ節照射療法は,単独療法および化学療法との併用療法ともに推奨されない。化学療法と併用される場合はISRTが推奨される。
1.限局期症例
限局期CHLでは初回治療として化学療法と放射線療法との併用療法(combined modality therapy:CMT)が行われる(CQ1)。現在,用いられている代表的なレジメンはABVD療法である(CQ1)。限局期CHLに対するABVD療法4コース後のISRTの治療成績は10年PFSが90%以上である。放射線療法による晩期毒性,特に肺,乳房,消化管の二次がんや心血管系疾患による遅発性の死亡が問題となり,化学療法単独の治療方法も選択肢の一つとされる(CQ2)。予後不良因子を持たない限局期CHLに対しては,有害事象の軽減のために化学療法の施行回数や照射量を減じる治療方法も実施可能である。予後不良群に対してはABVD療法4コース後ISRT 30Gy(CQ4)が推奨されるが,予後良好群に対してはABVD療法2コース後ISRT 20Gy(CQ3)も推奨される治療法の一つである。CMTにおいてはABVD療法終了時に明らかな進行(PD)と判定されない限り,ISRTを予定通り行い治療終了する。再発症例は進行期再発症例と同様の治療法が選択されることが多い。予後不良群においては初回治療中の中間PETによる層別化治療は有望な治療選択肢である(CQ8)。
2.進行期症例
進行期CHLの初回治療としてはABVD療法(6もしくは8コース)あるいはBV併用AVD療法(6コース)が推奨される(CQ6,7)。また,進行期症例においては初回治療中の中間PETによる層別化治療は有望な治療選択肢である(CQ8)。化学療法終了時にPETにてcomplete metabolic response (CMR)であれば治療は終了することが推奨される(CQ9)。CTにて完全奏効(CR)あるいは部分奏効(PR)が得られていても,PETにてCMRが得られなかった場合にはISRTの追加が考慮される(CQ9)。初回化学療法で安定(SD)以下あるいは化学療法後の再発症例では救援化学療法が施行されるが(CQ10),65歳以下で救援化学療法が奏効した場合かつ臓器機能が保たれていれば自家造血幹細胞移植併用大量化学療法(自家移植)が推奨される(CQ11)。また,再発・難治症例に対して,通常の救援化学療法(ICE,GDP,DHAP,ESHAP,CHASE療法など)に加えて,BV,抗PD-1抗体であるニボルマブ,ペムブロリズマブの高い有効性が報告されている(CQ10,12)。自家移植後再発した症例に対し,救援化学療法が奏効した場合には,同種造血幹細胞移植療法が治療選択肢となり得るが,その適応には注意を要する(CQ13)。
CQ1 初発限局期CHLに対する標準治療として化学療法と放射線療法の併用(CMT)は勧められるか
- 推奨グレード
- カテゴリー1
限局期CHLに対する標準治療は,予後良好群,予後不良群ともにCMTである。
解説
初発限局期CHL予後良好群に対するMOPP/ABV療法(HN2,VCR,PCZ,PSL/DXR,BLM,VBL)3コース+IFRT(involved-field radiotherapy)と,亜全リンパ節領域照射(subtotal nodal radiotherapy:STNR)単独療法を比較するランダム化第Ⅲ相比較試験(H8-F)では,5年EFSおよび10年OSのいずれにおいてもCMT群がSTNR単独群に比べ有意に良好な成績であった1)。予後不良群に対するMOPP/ABV療法4コース+IFRT群,MOPP/ABV療法6コース+IFRT群,MOPP/ABV療法4コース+STNR群の3群の比較試験(H8-U)では,5年EFS,10年OSともに3群間で有意差は認められなかった1)。
初発限局期CHL予後良好群に対するEBVP療法(EPI,BLM,VBL,PSL)6コース+IFRTとSTNR単独とを比較するH7-F試験では,10年EFSはCMT群で有意に良好であった2)。また予後不良群に対するEBVP療法6コース+IFRTとMOPP/ABV療法6コース+IFRTとを比較するH7-U試験では,10年EFSはMOPP/ABV療法によるCMT群が有意に良好な成績であった2)。
German Hodgkin Study Group(GHSG)による,初発限局期CHL予後良好群に対するEFRT(extended field radiation therapy)+IFRTのRT単独療法群とABVD療法(DXR,BLM,VBL,DTIC)2コース+EFRT+IFRTによるCMT群とを比較するHD7試験では3),15年PFSがそれぞれ52%,73%と有意にCMT群で優れていた4)。OSにおいて有意差は確認されなかった。
有害事象の観点から,放射線照射野の縮小についても検討されている。初発限局期CHL予後不良群に対するCOPP/ABVD療法(CPA,VCR,PCZ,PSL/DXR,BLM,VBL,DTIC)2コース後にEFRTもしくはIFRTを実施するランダム化比較試験(HD8)では5),5年治療成功割合(FFTF)が同等であり,OSにも有意差を認めなかった。急性期毒性はEFRTに比べIFRTで少ない傾向であった。なお近年では,正常組織に対する放射線障害を極力減らすため,照射野をより厳密に腫瘍部分に絞った病巣部放射線療法(involved site radiation therapy:ISRT)の実施が,CHLの分野においても推奨されている6,7)。
これらの結果を踏まえ,CMTは初発限局期CHL対する標準治療として適切であると考えられる。ただし,現在の標準的なCMTでは,放射線照射方法としてIFRTではなくISRTが推奨されている。
参考文献
1) Fermé C, et al. Chemotherapy plus involved-field radiation in early-stage Hodgkin’s disease. N Engl J Med. 2007; 357(19): 1916-27.(1iiD1)
2) Noordijk EM, et al. Combined-modality therapy for clinical stage I or II Hodgkin’s lymphoma: long-term results of the European Organisation for Research and Treatment of Cancer H7 randomized controlled trials. J Clin Oncol. 2006; 24(19): 3128-35.(1iiA)
3) Engert A, et al. Two cycles of doxorubicin, bleomycin, vinblastine, and dacarbazine plus extended-field radiotherapy is superior to radiotherapy alone in early favorable Hodgkin’s lymphoma: final results of the GHSG HD7 trial. J Clin Oncol. 2007; 25(23): 3495-502.(1iiDiii)
4) Sasse S, et al. Long-Term Follow-Up of Contemporary Treatment in Early-Stage Hodgkin Lymphoma: Updated Analyses of the German Hodgkin Study Group HD7, HD8, HD10, and HD11 Trials. J Clin Oncol. 2017; 35(18): 1999-2007.(1iiA)
5) Engert A, et al. Involved-field radiotherapy is equally effective and less toxic compared with extended-field radiotherapy after four cycles of chemotherapy in patients with early-stage unfavorable Hodgkin’s lymphoma: results of the HD8 trial of the German Hodgkin’s Lymphoma Study Group. J Clin Oncol. 2003; 21(19): 3601-8.(1iiDiii)
6) Specht L, et al. Modern radiation therapy for Hodgkin lymphoma: field and dose guidelines from the international lymphoma radiation oncology group(ILROG). Int J Radiat Oncol Biol Phys. 2014; 89(4): 854-62.
7) Wirth A, et al. Involved Site Radiation Therapy in Adult Lymphomas: An Overview of International Lymphoma Radiation Oncology Group Guidelines. Int J Radiat Oncol Biol Phys. 2020; 107(5): 909-33.(3iiiDiii)
CQ2 Bulky病変を認めない初発限局期CHLに対してABVD療法6コースは勧められるか
- 推奨グレード
- カテゴリー2B
Bulky病変を認めない初発限局期CHLに対して放射線療法を省略したABVD療法6コースは,推奨される治療選択肢の一つである。
解説
初発限局期CHLにおけるCMTの治療成績は,5年PFSにおいておよそ85%以上であるが,特に若年者においては放射線治療における心血管障害や二次がんなどの晩期毒性が問題となる。そのため放射線治療を併用しない,化学療法単独療法の有用性が検討されてきた。
Bulky病変を認めない小児初発限局期CHLに対するABVD療法(DXR,BLM,VBL,DTIC)6コースについての検討では,5年PFSが85~92%程度とCMTに遜色のない結果であった1,2)。COPP/ABV療法(CPA,VCR,PCZ,PSL/DXR,BLM,VBL)でCRとなった非bulky限局期CHLに対し,低線量IFRT実施群と未実施群のランダム化比較試験では,3年EFSではIFRT群で良好な結果であったが,OSにおいて有意差は認めなかった3)。非bulkyステージⅠ~ⅢA CHLに対するABVD療法6コース+IFRTRT(IFRTおよびmodified EFRT)群およびABVD療法6コース群の比較試験では,5年FFP,OSにおいて有意差を認めなかったが4),より大規模な試験の実施によりCMTの有用性が示される可能性についても指摘された。
National Cancer Institute of Canada(NCIC)臨床研究グループは,bulky病変を持たない限局期CHL予後良好群および予後不良群に対してABVD療法4~6コース実施するABVD群と,予後良好群に対してSTNR単独もしくは予後不良群に対してABVD療法2コース+STNRを実施するSTNR群の2群について,ランダム化比較試験(HD.6)を行った5)。12年FFDP(freedom from disease progression)は,STNR群で有意に良好であったが,OSはABVD群で有意に良好であった。これはABVD群において二次がんなどの原疾患以外による死亡が少ないためと考察された。
放射線療法に関連する晩期毒性として,心血管イベントや二次がんの発生は治療終了後10~40年経過しても経時的に増加し6-8),その罹患割合は一般に比べて約4~6倍にも達する。これらの晩期毒性は,投与線量を40Gyから30Gy程度に減量しても回避されないとされる6)。1965~2000年にオランダで治療を受けたCHL 3,905例(RTは87.8%に施行)の観察研究では,治療後40年における二次がん累積発症割合は48.5%であった8)。ただし,これらの放射線照射のデータは広い照射野設定に基づく比較的古い年代のものであり,現在推奨されている標準的な放射線照射による晩期毒性のエビデンスは限られていることに留意する。
以上より,bulky病変を認めない限局期CHLに対して,晩期毒性を最少化するために放射線療法を省略したABVD療法6コースは,治療法の選択肢の一つと考えられる。
また,中間PETを用いた治療層別化も検討されている。RATHL試験においては,限局期予後不良群および進行期CHLを対象とし,ABVD療法2コース後の中間PET(PET-2)陰性例においてブレオマイシン(BLM)のスキップに関する非劣性が検証された(PET-2陰性例では3~6コース目をAVD療法とする治療法が選択肢となった)9)。このエビデンスを考慮すると,bulky病変を認めない限局期CHLに対してABVD療法6コースを選択する際には,PET-2陰性例では3~6コース目をAVD療法とする治療法も選択肢の一つとなると考えられる。また,PET-2陽性例では増量BEACOPP療法(BLM,ETP,DXR,CPA,VCR,PCZ,PSL)4コース(60歳未満かつ予後不良群CHL)9),ABVD療法4コース+ISRT 30Gy(60歳以上もしくは予後良好群)10)も選択可能である。なお,中間PETによる層別化治療を選択しない場合には,ABVD療法6コースは治療選択肢の一つである。
参考文献
1) Rueda Domínguez A, et al. Treatment of stage I and II Hodgkin’s lymphoma with ABVD chemotherapy: results after 7 years of a prospective study. Ann Oncol. 2004; 15(12): 1798-804.(3iiiDiii)
2) Canellos GP, et al. Treatment of favorable, limited-stage Hodgkin’s lymphoma with chemotherapy without consolidation by radiation therapy. J Clin Oncol. 2010; 28(9): 1611-5.(3iiiDiii)
3) Nachman JB, et al. Randomized comparison of low-dose involved-field radiotherapy and no radiotherapy for children with Hodgkin’s disease who achieve a complete response to chemotherapy. J Clin Oncol. 2002; 20(18): 3765-71.(1iiDi)
4) Straus DJ, et al. Results of a prospective randomized clinical trial of doxorubicin, bleomycin, vinblastine, and dacarbazine(ABVD)followed by radiation therapy(RT)versus ABVD alone for stages I, II, and IIIA nonbulky Hodgkin disease. Blood. 2004; 104(12): 3483-9.(1iiDiii)
5) Meyer RM, et al. ABVD alone versus radiation-based therapy in limited-stage Hodgkin’s lymphoma. N Engl J Med. 2012; 366(5): 399-408.(1iiA)
6) Brusamolino E, et al. Long-term events in adult patients with clinical stage IA-IIA nonbulky Hodgkin’s lymphoma treated with four cycles of doxorubicin, bleomycin, vinblastine, and dacarbazine and adjuvant radiotherapy: a single-institution 15-year follow-up. Clin Cancer Res. 2006; 12(21): 6487-93.(3iiiDiv)
7) De Bruin ML, et al. Breast cancer risk in female survivors of Hodgkin’s lymphoma: lower risk after smaller radiation volumes. J Clin Oncol. 2009; 27(26): 4239-46.(3iiC)
8) Schaapveld M, et al. Second Cancer Risk Up to 40 Years after Treatment for Hodgkin’s Lymphoma. N Engl J Med. 2015; 373(26): 2499-511.(3iC)
9) Johnson P, et al. Adapted Treatment Guided by Interim PET-CT Scan in Advanced Hodgkin’s Lymphoma. N Engl J Med. 2016; 374(25): 2419-29.(1iiA)
10)André MPE, et al. Early Positron Emission Tomography Response-Adapted Treatment in Stage I and II Hodgkin Lymphoma: Final Results of the Randomized EORTC/LYSA/FIL H10 Trial. J Clin Oncol. 2017; 35(16): 1786-94.(1iiA)
CQ3 初発限局期CHL予後良好群に対してABVD療法2コースとISRTの併用(CMT)は勧められるか
- 推奨グレード
- カテゴリー2A
限局期CHL予後良好群では,ABVD療法2コース後のISRTは推奨される治療の一つである。
解説
初発限局期CHL予後良好群では長期予後が期待できる。有害事象の軽減を目的として,化学療法の実施回数を減らす,薬剤を減量する,放射線投与線量を減らすなどの臨床試験が実施されている。
GHSGによるHD10試験では,初発限局期CHL予後良好群に対してABVD療法(DXR,BLM,VBL,DTIC)2または4コース,およびその後のIFRT 20Gyまたは30Gyを比較する2×2ランダム化第Ⅲ相比較試験を実施した1,2)。5年FFTFおよびOSにおいて有意差は認めなかった。有害事象,急性毒性はABVD療法4コース+IFRT 30Gyで最も高かった。治療効果と有害事象を考慮すると,ABVD療法2コース+IFRT 20Gyは限局期CHL予後良好群に対する標準治療となると考えられた。
GHSG HD13試験では,限局期CHL予後良好群においてABVD療法の薬剤を減じる試みがされた3)。ABVD,ABV,AVD,AV療法それぞれ2コース後,IFRT 30Gyを実施するランダム化第Ⅲ相比較試験では,ABVDに対しABV,AV群で5年FFTFにおいて有意な劣性が,またAVDにおいても劣性の傾向が確認された。この結果,ABVD療法が標準治療と判断された。
中間PETの結果を参考にして治療強度を減弱する試みもされている。EORTC(European Organisation of Research and Treatment of Cancer),LYSA(Lymphoma Study Association),FIL(Fondazione Italiana Linfomi)によるH10F試験では,限局期CHL予後良好群に対してABVD療法2コース実施後に中間PETを実施し,陰性例に対してさらにABVD療法1コース+INRT 30Gy実施する群とABVD療法2コースのみ実施する群を比較した4)。5年PFSにおいてABVD単独群のABVD+INRT群に対する非劣性を確認できず,ABVD療法2コース後の中間PET陰性であってもRTを省略できないことが示された。GHSG HD16試験では,限局期CHL予後良好群にABVD療法2コース実施し,中間PET陰性例に対してIFRT 20Gyを実施する群と経過観察のみとする群とをランダムに比較した5)。5年PFSにおいてCMT群はABVD単独群に比べ有意に予後良好であった。このため,ABVD療法2コース後の中間PET陰性であっても,RTが必要であることが示された。また,IFRTに代わり,CHLに対する標準的な局所放射線照射方法として,ISRTが推奨されている6,7)。
これらを背景として,初発限局期CHL予後良好群に対してABVD療法2コースとISRT 20Gyの併用(CMT)は,推奨される治療法と考えられる。ただし,GHSG HD10試験1)で規定された限局期CHLリスク因子(縦隔病変,節外病変,血沈亢進,3カ所以上リンパ節領域)のいずれも有さない予後良好群に限定したエビデンスであることに留意する。
参考文献
1) Engert A, et al. Reduced treatment intensity in patients with early-stage Hodgkin’s lymphoma. N Engl J Med. 2010; 363(7): 640-52.(1iiDiii)
2) Sasse S, et al. Long-Term Follow-Up of Contemporary Treatment in Early-Stage Hodgkin Lymphoma: Updated Analyses of the German Hodgkin Study Group HD7, HD8, HD10, and HD11 Trials. J Clin Oncol. 2017; 35(18): 1999-2007.(1iiDiii)
3) Behringer K, et al. Omission of dacarbazine or bleomycin, or both, from the ABVD regimen in treatment of early-stage favourable Hodgkin’s lymphoma(GHSG HD13): an open-label, randomised, non-inferiority trial. Lancet. 2015; 385(9976): 1418-27.(1iiDiii)
4) André MPE, et al. Early Positron Emission Tomography Response-Adapted Treatment in Stage I and II Hodgkin Lymphoma: Final Results of the Randomized EORTC/LYSA/FIL H10 Trial. J Clin Oncol. 2017; 35(16): 1786-94.(1iiDfiii)
5) Fuchs M, et al. Positron Emission Tomography-Guided Treatment in Early-Stage Favorable Hodgkin Lymphoma: Final Results of the International, Randomized Phase III HD16 Trial by the German Hodgkin Study Group. J Clin Oncol. 2019; 37(31): 2835-45.(1iiDiii)
6) Specht L, et al. Modern radiation therapy for Hodgkin lymphoma: field and dose guidelines from the international lymphoma radiation oncology group(ILROG). Int J Radiat Oncol Biol Phys. 2014; 89(4): 854-62.
7) Wirth A, et al. Involved Site Radiation Therapy in Adult Lymphomas: An Overview of International Lymphoma Radiation Oncology Group Guidelines. Int J Radiat Oncol Biol Phys. 2020; 107(5): 909-33.(3iiiDiii)
CQ4 初発限局期CHL予後不良群に対してどのような治療が勧められるか
- 推奨グレード
- カテゴリー2A
限局期CHL予後不良群では,ABVD療法4コース+ISRTのCMTが推奨される。
- 推奨グレード
- カテゴリー2B
中間PETによる層別化治療(CQ8)も推奨される治療選択肢である。
解説
初発限局期CHL予後不良群に対するCOPP/ABVD療法(CPA,VCR,PCZ,PSL/DXR,BLM,VBL,DTIC)2コース後のEFRT 30Gy群とIFRT 30Gy単独群とを比較するランダム化第Ⅲ相比較試験(GHSG HD8試験)では1),IFRT群は5年FFTFおよびOSにおいてEFRT群に対し非劣性で有害事象も少ない傾向であったことから,IFRTによるCMTを標準治療とした。初発限局期CHL予後不良群における治療強度の削減を目指したH8-U試験(EORTC,GELA)では2),MOPP/ABV療法(CPA,VCR,PCZ,PSL/DXR,BLM,VBL)6コース+IFRT,4コース+IFRT,4コース+STNRをランダムに比較,EFS,OSともに有意差を認めないことから化学療法4コース+IFRTを標準治療とした。
初発限局期CHL予後不良群に対する化学療法の強度を高めてIFRTの線量の減量を目指したGHSG HD11試験では3,4),ABVD療法4コースと標準BEACOPP療法(BLM,ETP,DXR,CPA,VCR,PCZ,PSL)4コース,IFRT 20Gyと30Gyを2×2で比較,治療効果と毒性の評価からABVD+IFRT 30Gyが標準治療であるとした。増量BEACOPP療法の効果を検討したHD14試験では5,6),増量BEACOPP療法2コース+ABVD療法2コース+IFRT 30Gy群はABVD療法4コース+IFRT 30Gy群に比べ5年FFTF,PFSが有意に良好であり(OSは同等),以降GHSGにおける標準治療となった。縦隔bulky病変を有する限局期CHLに対する強度を高めたStanford VによるCMTの有効性を確認する試験では7),Stanford VのABVD療法を上回る効果は確認されなかった。NCIC臨床研究グループにおけるHD.6では,初発限局期CHL予後不良群に対しABVD療法2コース+STNR 35GyのCMT群とABVD療法4~6コース群を比較した。12年FFDPはCMT群で有意に良好であったが,OSはABVD単独群で有意に良好であった。この背景にCMTによる毒性が関与するとされるが,近年CHLに対する標準的な局所放射線療法として,ISRTが推奨されており8,9),本試験結果の解釈には配慮を要する。
限局期CHL予後不良群に対する化学療法後に中間PETを実施し,陰性例ではRTを省略して有害事象を減らす,また陽性例に対して治療強度を強化して治療効果を高める試験も報告されている(CQ8)10,11)。RATHL試験では,限局期予後不良群および進行期CHLのPET-2陰性例においてブレオマイシン(BLM)のスキップに関する非劣性が検証された(PET-2陰性例では3~6コース目をAVD療法とする治療法が選択肢となった)12)。初発限局期CHL予後不良群に対するブレンツキシマブ ベドチン(BV)併用AVD療法の検討では,BV併用AVD療法4コースの後のPET(PET-4)陰性例に対し,ISRT 30Gy,ISRT 20Gy,地固め用量放射線治療(CVR)30Gy,放射線治療なしの4つのコホートが実施された13)。CR割合,2年PFSともにいずれも90%以上と良好な成績で有害事象も許容範囲であり,PET-4陰性例においては放射線治療の減弱や削除が考慮可能とされた。なお,限局期CHLに対するBV併用AVD療法のエビデンスはランダム化比較試験に基づくものではないため,臨床試験として実施するのが望ましい。
これらを背景として,初発限局期CHL予後不良群に対してABVD療法4コースとISRT 30Gyの併用(CMT)は,推奨される治療法と考えられる。また,中間PETによる層別化治療として,ABVD療法2コース後のPET-2陰性例ではAVD療法4コース,PET-2陽性例では増量BEACOPP療法4コース(60歳未満),ABVD療法4コース+ISRT 30Gy(60歳以上)が推奨される治療選択肢である。また,増量BEACOPP療法2コース+ABVD療法2コース後のPET-4陰性例ではISRTをスキップすることが可能である。
参考文献
1) Engert A, et al. Involved-field radiotherapy is equally effective and less toxic compared with extended-field radiotherapy after four cycles of chemotherapy in patients with early-stage unfavorable Hodgkin’s lymphoma: results of the HD8 trial of the German Hodgkin’s Lymphoma Study Group. J Clin Oncol. 2003; 21(19): 3601-8.(1iiA)
2) Fermé C, et al. Chemotherapy plus involved-field radiation in early-stage Hodgkin’s disease. N Engl J Med. 2007; 357(19): 1916-27.(1iiD1)
3) Eich HT, et al. Intensified chemotherapy and dose-reduced involved-field radiotherapy in patients with early unfavorable Hodgkin’s lymphoma: final analysis of the German Hodgkin Study Group HD11 trial. J Clin Oncol. 2010; 28(27): 4199-206.(1iiDiii)
4) Sasse S, et al. Long-Term Follow-Up of Contemporary Treatment in Early-Stage Hodgkin Lymphoma: Updated Analyses of the German Hodgkin Study Group HD7, HD8, HD10, and HD11 Trials. J Clin Oncol. 2017; 35(18): 1999-2007.(1iiDiii)
5) von Tresckow B, et al. Dose-intensification in early unfavorable Hodgkin’s lymphoma: final analysis of the German Hodgkin Study Group HD14 trial. J Clin Oncol. 2012; 30(9): 907-13.(1iiDiii)
6) Gillessen S, et al. Intensified treatment of patients with early stage, unfavourable Hodgkin lymphoma: long-term follow-up of a randomised, international phase 3 trial of the German Hodgkin Study Group(GHSG HD14). Lancet Haematol. 2021; 8(4): e278-88.(1iiDiii)
7) Advani RH, et al. Randomized Phase III Trial Comparing ABVD Plus Radiotherapy With the Stanford V Regimen in Patients With Stages I or II Locally Extensive, Bulky Mediastinal Hodgkin Lymphoma: A Subset Analysis of the North American Intergroup E2496 Trial. J Clin Oncol 2015; 33(17): 1936-42.(1ii-Diii)
8) Specht L, et al. Modern radiation therapy for Hodgkin lymphoma: field and dose guidelines from the international lymphoma radiation oncology group(ILROG). Int J Radiat Oncol Biol Phys. 2014; 89(4): 854-62.
9) Wirth A, et al. Involved Site Radiation Therapy in Adult Lymphomas: An Overview of International Lymphoma Radiation Oncology Group Guidelines. Int J Radiat Oncol Biol Phys. 2020; 107(5): 909-33.
10)André MPE, et al. Early Positron Emission Tomography Response-Adapted Treatment in Stage I and II Hodgkin Lymphoma: Final Results of the Randomized EORTC/LYSA/FIL H10 Trial. J Clin Oncol. 2017; 35(16): 1786-94.(1iiDiii)
11)Borchmann P, et al. PET-guided omission of radiotherapy in early-stage unfavourable Hodgkin lymphoma(GHSG HD17): a multicentre, open-label, randomised, phase 3 trial. Lancet Oncol. 2021; 22(2): 223-34.(1iiDiii)
12)Johnson P, et al. Adapted Treatment Guided by Interim PET-CT Scan in Advanced Hodgkin’s Lymphoma. N Engl J Med. 2016; 374(25): 2419-29.(1iiDiii)
13)Kumar A, et al. Brentuximab Vedotin Combined With Chemotherapy in Patients With Newly Diagnosed Early-Stage, Unfavorable-Risk Hodgkin Lymphoma. J Clin Oncol. 2021; 39(20): 2257-65.(2Diii)
CQ5 NLPHLに対してどのような治療が勧められるか
- 推奨グレード
- カテゴリー2A
限局期NLPHLではISRTが推奨される。
解説
CHLの病型のうち,結節硬化型,混合細胞型に比べて,NLPHLの発生頻度は低く,NLPHLのみを対象とした前方視的臨床試験の報告はない。GHSGの複数の臨床試験(HD4,HD7,HD10,LPHL IA試験など)に登録されたリスク因子を持たないステージⅠAのNLPHLについての後方視的解析では1,2),EFRT群,IFRT群,CMT群のいずれにおいても良好な成績で,治療関連毒性のリスクが最も低いIFRT単独治療が標準治療と考察された。その後,IFRTに代わり,CHLに対する標準的な局所放射線療法としてISRTが推奨されており3,4),NLPHLを対象としたISRTのエビデンスも報告されている5)。米国の限局期NLPHLにおける治療成績の後方視的解析では6),RT単独療法の照射野の違いによる効果の違いや,CMTの優位性も確認されず,照射野を限ったRTが標準治療であると結論付けた。International Lymphoma Radiation Oncology Group(ILROG)による限局期NLPHLにおける治療成績を評価する後方視的解析では7),同様にRT単独療法の優位性が確認された一方で,一部のリスクを持つ症例におけるCMTの有用性についても言及した。ABVD療法+RTによるCMTの有効性を示したいくつかの後方視的解析の報告があるが8-10),どのような症例がCMTを要するかについては未だ明確ではない。
また,手術により単一リンパ節病変が完全切除された例において長期予後が見込める場合があること11),一部の症例においては診断時から一定期間注意深い経過観察が可能であり,生命予後にも影響を与えない可能性があることについても報告されている12)。いずれも後方視的解析であり,今後の検討が待たれる。
参考文献
1) Eichenauer DA, et al. Long-Term Course of Patients With Stage IA Nodular Lymphocyte-Predominant Hodgkin Lymphoma: A Report From the German Hodgkin Study Group. J Clin Oncol. 2015; 33(26): 2857-62.(3iiiDiii)
2) Nogová L, et al. Extended field radiotherapy, combined modality treatment or involved field radiotherapy for patients with stage IA lymphocyte-predominant Hodgkin’s lymphoma: a retrospective analysis from the German Hodgkin Study Group(GHSG). Ann Oncol. 2005; 16(10): 1683-7.(3iiiDii)
3) Specht L, et al. Modern radiation therapy for Hodgkin lymphoma: field and dose guidelines from the international lymphoma radiation oncology group(ILROG). Int J Radiat Oncol Biol Phys. 2014; 89(4): 854-62.
4) Wirth A, et al. Involved Site Radiation Therapy in Adult Lymphomas: An Overview of International Lymphoma Radiation Oncology Group Guidelines. Int J Radiat Oncol Biol Phys. 2020; 107(5): 909-33.(3iiiDiii)
5) Pinnix CC, et al. Favorable outcomes with de-escalated radiation therapy for limited-stage nodular lymphocyte-predominant Hodgkin lymphoma. Blood Adv. 2019; 3(9): 1356-67.(3iiiDiii)
6) Chen RC, et al. Early-stage, lymphocyte-predominant Hodgkin’s lymphoma: patient outcomes from a large, single-institution series with long follow-up. J Clin Oncol. 2010; 28(1): 136-41.(3iiiA)
7) Binkley MS, et al. Stage I-II nodular lymphocyte-predominant Hodgkin lymphoma: a multi-institutional study of adult patients by ILROG. Blood. 2020; 135(26): 2365-74.(3iiiDiii)
8) Eichenauer DA, et al. Long-Term Follow-Up of Patients With Nodular Lymphocyte-Predominant Hodgkin Lymphoma Treated in the HD7 to HD15 Trials: A Report From the German Hodgkin Study Group. J Clin Oncol. 2020; 38(7): 698-705.(3iiiDiii)
9) Savage KJ, et al. Treating limited-stage nodular lymphocyte predominant Hodgkin lymphoma similarly to classical Hodgkin lymphoma with ABVD may improve outcome. Blood. 2011; 118(17): 4585-90.(3iiiA)
10)Cheng PTM, et al. Outcome of limited-stage nodular lymphocyte-predominant Hodgkin lymphoma and the impact of a PET-adapted approach. Blood Adv. 2021; 5(18): 3647-55.(3iiiDiii)
11)Appel BE, et al. Minimal Treatment of Low-Risk, Pediatric Lymphocyte-Predominant Hodgkin Lymphoma: A Report From the Children’s Oncology Group. J Clin Oncol. 2016; 34(20): 2372-9.(3iiiDi)
12)Borchmann S, et al. Active surveillance for nodular lymphocyte-predominant Hodgkin lymphoma. Blood 2019; 133(20): 2121-9.(3iiDiii)
CQ6 初発進行期CHLに対してどのような治療が勧められるか
- 推奨グレード
- カテゴリー1
初発進行期CHLに対する標準治療として,中間PETによる層別化治療(ABVD or ABVD/増量BEACOPP療法),もしくはブレンツキシマブ ベドチン併用AVD療法が勧められる。
解説
初発進行期CHLは限局期に比べて治療成績が劣る1)。初発進行期CHLに対する標準治療として,中間PETによる層別化治療(ABVD or ABVD/増量BEACOPP療法)もしくは,BV併用AVD療法が勧められる。
初発進行期CHLの標準治療として,本邦および米国においてはABVD療法が実施されてきた一方で2,3),ドイツを中心とした欧州においては増量BEACOPP療法が実施されてきた4)。ABVD療法に比べて,増量BEACOPP療法は,その毒性は強いものの,優れたPFS延長効果をもたらすことが検証されているが4),再発・再燃以降に自家移植を設定した場合にはOS延長効果は限定的である5)。
また,CHLにおいては中間PETが予後予測に有用であり(詳しくはCQ8を参照),初発進行期CHLを対象としてABVD療法2コース後の中間PET(PET-2)陽性例に増量BEACOPP療法に変更し,PET-2陰性例にABVD療法あるいはAVD療法[ブレオマイシン(BLM)をスキップ]を行う臨床試験が複数実施された。
本邦において,60歳以下の進行期CHLを対象としたJCOG1305試験が実施され,PET-2陽性例に増量BEACOPP療法6コース,PET-2陰性例にABVD療法4コース(計6コース)を行う設定で,化学療法後PRかつ単一領域に残存病変を認めた場合にはISRTを行うデザインとした。その結果,主要評価項目である全適格例およびPET-2陽性例の2年PFSはそれぞれ84.8%,84.2%であり,事前に設定した閾値である75%および35%を上回ることが検証された6)。
海外の3つの試験(RATHL,SWOG S0816,GITIL/FIL HD0607)においても同様に,PET-2陽性例に対する増量BEACOPP療法への切り替えにより2年あるいは3年PFSは60~65%と良好な成績が示されている7-9)。また,RATHL試験では,PET-2陰性例においてABVD療法あるいはAVD療法のランダム化比較がされ,当初設定した非劣性マージンは達成できなかったものの7),PET-2陰性例におけるAVD療法への切り替えは複数のガイドラインで治療選択肢として記載されている10,11)。特に60歳を超える高齢者やBLM肺毒性のリスク因子を有する若年者ではPET-2陰性例でBLMをスキップする選択は重要と考えられる12)。
なお,有害事象軽減を目指した臨床試験の結果がJCOG-LSGから報告されている。ABVD療法の消化器毒性の軽減を目的に,限局期(Ⅱ期)および進行期CHLを対象とし,ダカルバジン(DTIC)を減量したABVd療法の単群第Ⅱ相試験では,CR割合81%,5年PFS 78.4%と有効性が確認され,有害事象も許容範囲であった1,13)。DTICを使用しないABV療法においては,同一背景の患者集団に比べてPFSが不良であり,DTICは省略すべきではないことが確認された14)。
未治療進行期CHLに対するBV併用AVD療法とABVD療法とのランダム化比較第Ⅲ相試験では14),2年修正PFSにおいてBV併用AVD療法がABVD療法に比べて有意に良好な成績であり,5年の長期フォローアップにおいても同様の結果が確認された15)。その後,約6年の長期フォローアップにおいて,BV併用AVD療法がOSの延長に寄与することが報告されたが16),OSイベントの差に関連した二次がんやBLM関連肺毒性について懸念が示されている17)。それぞれの治療法における有害事象は異なっており,ABVD療法におけるBLM関連肺毒性,BV併用AVD療法における発熱性好中球減少症には注意を要する。BV併用AVD療法ではG-CSFの一次予防投与が推奨される。
一方,60歳を超える高齢者CHLにおいては,増量BEACOPP療法は適応できず,BV併用AVD療法の有用性も限定的である(CQ7参照)。したがって,中間PETによる層別化治療を行わない場合にはABVD療法(6もしくは8コース)も治療選択肢となり得る。
参考文献
1) Makita S, et al. Clinical features and outcomes of 139 Japanese patients with Hodgkin lymphoma. Int J Hematol. 2016; 104(2): 236-44.(3iiiDiii)
2) Ogura M, et al. Phase II study of ABVd therapy for newly diagnosed clinical stage II-IV Hodgkin lymphoma: Japan Clinical Oncology Group study(JCOG 9305). Int J Hematol. 2010; 92(5): 713-24.(3iiiDiv)
3) Canellos GP, et al. Chemotherapy of advanced Hodgkin’s disease with MOPP, ABVD, or MOPP alternating with ABVD. N Engl J Med. 1992; 327(21): 1478-84.(1iiA)
4) Engert A, et al. Escalated-dose BEACOPP in the treatment of patients with advanced-stage Hodgkin’s lymphoma: 10 years of follow-up of the GHSG HD9 study. J Clin Oncol. 2009; 27(27): 4548-54.(1iiDi)
5) Viviani S, et al. ABVD versus BEACOPP for Hodgkin’s lymphoma when high-dose salvage is planned. N Engl J Med. 2011; 365(3): 203-12.(1iiDi)
6) Kusumoto S, et al. Interim PET-guided ABVD or ABVD/escalated BEACOPP regimen for newly diagnosed advanced-stage classic Hodgkin lymphoma(JCOG1305, INNOVATE-HL study). ASH 2022 abstract.(3iiiDiv)
7) Johnson P, et al. Adapted Treatment Guided by Interim PET-CT Scan in Advanced Hodgkin’s Lymphoma. N Engl J Med. 2016; 374(25): 2419-29.(1iiDiii)
8) Press OW, et al. US Intergroup Trial of Response-Adapted Therapy for Stage III to IV Hodgkin Lymphoma Using Early Interim Fluorodeoxyglucose-Positron Emission Tomography Imaging: Southwest Oncology Group S0816. J Clin Oncol. 2016; 34(17): 2020-7.(3iiiDiii)
9) Gallamini A, et al. Early Chemotherapy Intensification With Escalated BEACOPP in Patients With Advanced-Stage Hodgkin Lymphoma With a Positive Interim Positron Emission Tomography/Computed Tomography Scan After Two ABVD Cycles: Long-Term Results of the GITIL/FIL HD 0607 Trial. J Clin Oncol. 2018; 36(5): 454-62.(3iiiDiii)
10)NCCN guideline 2022 Hodgkin Lymphoma.
11)Guideline for the first-line management of Classical Hodgkin Lymphoma - A British Society for Haematology guideline.
12)UpToDate. Initial treatment of advanced(stage III-IV)classic Hodgkin lymphoma.
13)Ogura M, et al. Phase II study of ABV(doxorubicin with increased dose, bleomycin and vinblastine)therapy in newly diagnosed advanced-stage Hodgkin lymphoma: Japan Clinical Oncology Group study(JCOG9705). Leuk Lymphoma. 2013; 54(1): 46-52.(3iiiDiii)
14)Connors JM, et al. Brentuximab Vedotin with Chemotherapy for Stage III or IV Hodgkin’s Lymphoma. N Engl J Med. 2018; 378(4): 331-44.(1iiDi)
15)Straus DJ, et al. Brentuximab vedotin with chemotherapy for stage III or IV classical Hodgkin lymphoma(ECHELON-1): 5-year update of an international, open-label, randomised, phase 3 trial. Lancet Haematol. 2021; 8(6): e410-21.(1iiD1)
16)Ansell SM, et al. Overall Survival with Brentuximab Vedotin in Stage III or IV Hodgkin’s Lymphoma. N Engl J Med. 2022; 387(4): 310-20.(1iiDi)
17)Longo DL, et al. A Better Treatment for Advanced-Stage Hodgkin’s Lymphoma? N Engl J Med. 2022; 387(4): 370-2.
CQ7 高齢者(60歳以上)初発進行期CHLに対してどのような治療が勧められるか
- 推奨グレード
- カテゴリー2B
高齢者進行期CHLでは,A(B)VD療法もしくはブレンツキシマブ ベドチン併用AVD療法が推奨されるが,併存疾患の有無などを考慮のうえ治療選択するとともに,有害事象には注意を要する。
解説
高齢者CHLに対する治療選択においては,日常生活動作(activities of daily living:ADL)の低下や併存疾患の有無などについて考慮する必要がある。60歳以上の高齢者CHL(進行期例を約6割含む)に対する治療の実態を確認する後方視的解析では1),約1割の症例でADL不良を伴っており,約2割の症例で臨床的に問題となる何らかの併存疾患を有していた。通常化学療法(ABVD,AVD,BV併用AVD療法)を実施した症例のPFS,OSは,それ以外の治療を受けた例に比べ有意に良好であった。また,ADL低下例においては予後不良であり,併存疾患を有する患者においては毒性による治療中止の割合が高いことも観察された。また,65歳以上初発CHL(進行期例を約半数含む)についての大規模な後方視的観察研究では2),標準治療からの治療強度の減弱が,リンパ腫関連死亡リスクの上昇と関連する可能性が示された。
治療レジメンはABVD療法およびその関連治療が中心であり,またブレンツキシマブ ベドチン(BV)を組み入れた治療法も検討されている。60歳以上のCHLに対するABVD療法の後方視的解析では,約8割でCRを確認したが,死亡例を含むGrade 3以上の肺毒性を約2割に認め,特にブレオマイシン(BLM)の使用には十分な注意を要すると考えられた。初発進行期CHLに対するABVD療法とBV併用AVD療法の有効性を比較する第Ⅲ相試験における,60歳以上の高齢者についてのサブグループ解析では3),修正PFSにおいて両群で有意差を認めなかった。有害事象として,ABVD群では肺毒性,BV併用AVD群では発熱性好中球減少症と末梢神経障害の頻度が高く,注意を要すると考えられた。これらの治療法における十分なエビデンスは未だ蓄積しておらず,今後の検討が待たれる。現状においては,患者の併存疾患の有無などを考慮して,個々に注意深く治療選択をすることが望まれる。
高齢者CHLに対するその他の治療方法として,BV単独療法4),BV+DTIC療法5),BV/AVD/BV療法6),PVAG療法(PSL,BVL,DXR,GEM)7),CHOP療法(CPA,DXR,VCR,PSL)8)など検討されており,一定の効果を認め毒性も許容範囲とされているが,いずれもABVD療法以上の有用性は確認していない。また,治療強度を高めたStanford V9)や標準BEACOPP療法(BLM,ETP,DXR,CPA,VCR,PCZ,PSL)10)では,治療関連毒性が高い可能性が指摘されている。
参考文献
1) Orellana-Noia VM, et al. Multicenter analysis of geriatric fitness and real-world outcomes in older patients with classical Hodgkin lymphoma. Blood Adv. 2021; 5(18): 3623-32.(3iiiDiii)
2) Rodday AM, et al. Association of Treatment Intensity With Survival in Older Patients With Hodgkin Lymphoma. JAMA Netw Open. 2021; 4(10): e2128373.(3iB)
3) Evens AM, et al. Older patients(aged ≥ 60 years)with previously untreated advanced-stage classical Hodgkin lymphoma: a detailed analysis from the phase III ECHELON-1 study. Haematologica. 2022; 107(5): 1086-94.(3iiiDi)
4) Forero-Torres A, et al. Phase 2 study of frontline brentuximab vedotin monotherapy in Hodgkin lymphoma patients aged 60 years and older. Blood. 2015; 126(26): 2798-804.(3iiiDiv)
5) Friedberg JW, et al. Frontline brentuximab vedotin in combination with dacarbazine or bendamustine in patients aged ≥ 60 years with HL. Blood. 2017; 130(26): 2829-37.(3iiiDiv)
6) Evens AM, et al. Multicenter Phase II Study of Sequential Brentuximab Vedotin and Doxorubicin, Vinblastine, and Dacarbazine Chemotherapy for Older Patients With Untreated Classical Hodgkin Lymphoma. J Clin Oncol. 2018; 36(30): 3015-22.(3iiiDiv)
7) Böll B, et al. Phase 2 study of PVAG(prednisone, vinblastine, doxorubicin, gemcitabine)in elderly patients with early unfavorable or advanced stage Hodgkin lymphoma. Blood. 2011; 118(24): 6292-8.(3iiiDiv)
8) Kolstad A, et al. Standard CHOP-21 as first line therapy for elderly patients with Hodgkin’s lymphoma. Leuk Lymphoma. 2007; 48(3): 570-6.(3iiiDiv)
9) Evens AM, et al. The efficacy and tolerability of adriamycin, bleomycin, vinblastine, dacarbazine and Stanford V in older Hodgkin lymphoma patients: a comprehensive analysis from the North American intergroup trial E2496. Br J Haematol. 2013; 161(1): 76-86.(3iiiDiii)
10)Ballova V, et al. A prospectively randomized trial carried out by the German Hodgkin Study Group(GHSG)for elderly patients with advanced Hodgkin’s disease comparing BEACOPP baseline and COPP-ABVD(study HD9elderly). Ann Oncol. 2005; 16(1): 124-31.(1iiDii)
CQ8 初発CHLに対して初回治療中間でのFDG-PET検査(中間PET)による層別化治療は勧められるか
- 推奨グレード
- カテゴリー2A
初発限局期予後不良群および進行期CHLに対し,中間PETによる層別化治療は推奨される治療選択肢である。
解説
CHLにおいては治療中間でのFDG-PET所見(中間PET)が予後予測に有用であることが報告され1-4),中間PETによる効果判定に基づき,レジメンを変更する層別化治療に関する臨床試験が実施されてきた。初発限局期予後良好群CHLを対象とし,ABVD療法2ないしは3コース後の中間PET陰性例において局所放射線療法を省略(スキップ)する試験が実施されたが,いずれも非劣性は検証できなかった5-9)。初発限局期予後不良群CHLを対象とし,増量BEACOPP療法(BLM,ETP,DXR,CPA,VCR,PCZ,PSL)2コース+ABVD療法(DXR,BLM,VBL,DTIC)2コース後の中間PET(PET-2)陰性例において,局所放射線療法をスキップする非劣性が検証された(GHSG HD17)10)。また,初発限局期bulky病変を有するCHLを対象とし,PET-2陰性例にABVD療法4コース,PET-2陽性例に増量BEACOPP療法4コース+IFRT 30.6Gyを行う層別化治療を行い,優れた治療成績が報告された11)。また,初発進行期CHLを対象とし,PET-2陽性例において増量BEACOPP療法への変更を行う試験デザインで,ヒストリカルコントロールであるABVD療法6~8コース後のPFS 15~30%と比較して,増量BEACOPP療法に治療変更したPET-2陽性例のPFSは60~65%と良好であった(RATHL,SWOG S0816,GITIL/FIL HD0607)12-14)。また,上述したRATHL試験においては,限局期予後不良群および進行期CHLのPET-2陰性例においてブレオマイシン(BLM)のスキップに関する非劣性が検証された(中間PET陰性例ではAVD療法4コースが治療選択肢となった)12)。日本人の進行期CHLを対象としたJCOG1305試験は上述したSWOG S0816と同様の試験デザインで実施され,PET-2陽性例に増量BEACOPP療法6コース,PET-2陰性例にABVD療法4コース(計6コース)を行う設定で,化学療法後PRかつ単一領域に残存病変を認めた場合にはISRTを行うデザインであった。その結果,主要評価項目である全適格例およびPET-2陽性例の2年PFSはそれぞれ84.8%,84.2%であり,事前に設定した閾値である75%および30%を上回ることが検証された15)。
以上の結果より,初発限局期予後不良群および進行期CHLに対し,中間PETによる層別化治療は推奨される治療選択肢である。
なお,中間PETによる層別化治療のエビデンスのうち,PET-2陽性例に対する増量BEACOPP療法は60歳を超えるCHLには適用できない。また,SWOG S0816試験において,中間PET陰性的中率の低さおよび増量BEACOPP療法後の二次がんリスクに関する懸念が報告されており16),他の試験も含めた長期フォローアップデータが待たれる。また,進行期CHLを対象とした増量BEACOPP療法後の中間PETに基づく層別化治療試験も実施されており,中間PET陰性例に治療強度を減弱する有用性が報告されている17-19)。
参考文献
1) Gallamini A, et al. Early interim 2-[18F]fluoro-2-deoxy-D-glucose positron emission tomography is prognostically superior to international prognostic score in advanced-stage Hodgkin’s lymphoma: a report from a joint Italian-Danish study. J Clin Oncol. 2007; 25(24): 3746-52.(3iiiDiii)
2) Markova J, et al. FDG-PET for assessment of early treatment response after four cycles of chemotherapy in patients with advanced-stage Hodgkin’s lymphoma has a high negative predictive value. Ann Oncol. 2009; 20(7): 1270-4.(3iiiDiii)
3) Barrington SF, et al. Role of imaging in the staging and response assessment of lymphoma: consensus of the International Conference on Malignant Lymphomas Imaging Working Group. J Clin Oncol. 2014; 32(27): 3048-58.
4) Aldin A, et al. Interim PET-results for prognosis in adults with Hodgkin lymphoma: a systematic review and meta-analysis of prognostic factor studies. Cochrane Database Syst Rev. 2020; 1(1): CD012643.
5) Radford J, et al. Results of a trial of PET-directed therapy for early-stage Hodgkin’s lymphoma. N Engl J Med. 2015; 372(17): 1598-607.(1iiDiii)
6) André MPE, et al. Early Positron Emission Tomography Response-Adapted Treatment in Stage I and II Hodgkin Lymphoma: Final Results of the Randomized EORTC/LYSA/FIL H10 Trial. J Clin Oncol. 2017; 35(16): 1786-94.(1iiDiii)
7) Fuchs M, et al. Positron Emission Tomography-Guided Treatment in Early-Stage Favorable Hodgkin Lymphoma: Final Results of the International, Randomized Phase III HD16 Trial by the German Hodgkin Study Group. J Clin Oncol. 2019; 37(31): 2835-45.(1iiDiii)
8) Barrington SF, et al. Positron Emission Tomography Score Has Greater Prognostic Significance Than Pretreatment Risk Stratification in Early-Stage Hodgkin Lymphoma in the UK RAPID Study. J Clin Oncol. 2019; 37(20): 1732-41.(3iiiDiii)
9) Shaikh PM, et al. Consolidation radiotherapy following positron emission tomography complete response in early-stage Hodgkin lymphoma: a meta-analysis. Leuk Lymphoma. 2020; 61(7): 1610-7.(3iiiDiii)
10)Borchmann P, et al. PET-guided omission of radiotherapy in early-stage unfavourable Hodgkin lymphoma(GHSG HD17): a multicentre, open-label, randomised, phase 3 trial. Lancet Oncol. 2021; 22(2): 223-34.(1iiDiii)
11)LaCasce AS, et al. Positron Emission Tomography-Adapted Therapy in Bulky Stage I/II Classic Hodgkin Lymphoma: CALGB 50801(Alliance). J Clin Oncol. 2023; 41(5): 1023-34.(3iiiDiii)
12)Johnson P, et al. Adapted Treatment Guided by Interim PET-CT Scan in Advanced Hodgkin’s Lymphoma. N Engl J Med. 2016; 374(25): 2419-29.(1iiDiii)
13)Press OW, et al. US Intergroup Trial of Response-Adapted Therapy for Stage III to IV Hodgkin Lymphoma Using Early Interim Fluorodeoxyglucose-Positron Emission Tomography Imaging: Southwest Oncology Group S0816. J Clin Oncol. 2016; 34(17): 2020-7.(3iiiDiii)
14)Gallamini A, et al. Early Chemotherapy Intensification With Escalated BEACOPP in Patients With Advanced-Stage Hodgkin Lymphoma With a Positive Interim Positron Emission Tomography/Computed Tomography Scan After Two ABVD Cycles: Long-Term Results of the GITIL/FIL HD 0607 Trial. J Clin Oncol. 2018; 36(5): 454-62.(3iiiDiii)
15)Kusumoto S, et al. Interim PET-guided ABVD or ABVD/escalated BEACOPP regimen for newly diagnosed advanced-stage classic Hodgkin lymphoma(JCOG1305, INNOVATE-HL study). ASH 2022 abstract 1614.(3iiiDiv)
16)Stephens DM, et al. Five-year follow-up of SWOG S0816: limitations and values of a PET-adapted approach with stage III/IV Hodgkin lymphoma. Blood. 2019; 134(15): 1238-46.(3iiiDiii)
17)Borchmann P, et al. Progression-free survival of early interim PET-positive patients with advanced stage Hodgkin’s lymphoma treated with BEACOPPescalated alone or in combination with rituximab(HD18): an open-label, international, randomised phase 3 study by the German Hodgkin Study Group. Lancet Oncol. 2017; 18(4): 454-63.(1iiDiii)
18)Borchmann P, et al. PET-guided treatment in patients with advanced-stage Hodgkin’s lymphoma(HD18): final results of an open-label, international, randomised phase 3 trial by the German Hodgkin Study Group. Lancet. 2017; 390(10114): 2790-802.(1iiDiii)
19)Casasnovas RO, et al. PET-adapted treatment for newly diagnosed advanced Hodgkin lymphoma(AHL2011): a randomised, multicentre, non-inferiority, phase 3 study. Lancet Oncol. 2019; 20(2): 202-15.(1iiDiii)
CQ9 初発進行期CHLに対して地固め療法としてISRTは勧められるか
- 推奨グレード
- カテゴリー4
初発進行期CHLで化学療法後PETによりCMRが得られた症例に対するISRTは推奨されない。
解説
CHLに対する化学療法後の治療効果判定は,CTに加えてFDG-PET/CTで行うことが一般的になってきた。FDG-PET/CT以前のデータとして,化学療法によりCRとなった場合には,地固め療法としての局所放射線療法は予後を改善しなかったのに対し,残存病変への局所放射線療法は予後を改善することが示されてきた1-4)。一方,CR後の局所放射線療法あるいはCR後の化学療法追加が予後を改善する報告があった5,6)。また,CHLに対する標準的な局所放射線療法として,ISRTが推奨されてきた7,8)。
初発進行期CHLを対象とし,増量BEACOPP療法8コース,増量BEACOPP療法6コース,BEACOPP-14療法8コースにランダム化割付され,各群の化学療法後に2.5cm以上のPET陽性の残存病変に限定し30GyのRTを追加した(GHSG HD15)。5年のFFTF(主要評価項目)は増量BEACOPP療法6コースが良好であった。PET陰性PRとCR/CRuの4年PFSは同等であったのに対し,PET陽性PRの4年PFSは劣る結果であった9,10)。以上より,初発進行期CHLで化学療法後のCTにてPRであってもPETにてCMRであれば,追加のISRTは不要であることが示唆された。
また,5cm以上の腫瘤性病変を有する初発進行期CHLを対象とし,ABVD療法2コース後の中間PET(PET-2)および同6コース後の中間PET(PET-6)がいずれもCMRであった症例を地固め局所放射線療法(RT)群および非照射群にランダム化割付した(HD0607)。6年PFS(主要評価項目)はRT群および非照射群で差を認めなかった11)。同様に,5cm以上の腫瘤性病変を有する初発進行期CHLを対象に,ABVD療法後のPET-2,PET-6いずれもCMRであり,治療前5cm以上の腫瘤を有した例をRT群および非照射群にランダム化割付した(FIL HD0801)。2年のEFS(主要評価項目)はRT群および非照射群で差を認めなかった12)。以上2試験の結果は,初発時5cm以上の腫瘤病変を有している進行期CHLにおいて,PET-2およびPET-6がCMRであれば地固め局所放射線療法はスキップ可能であることを示した。
したがって,初発進行期CHLで化学療法によりCMRが得られた場合には,ISRTは推奨されない。
参考文献
1) Aleman BM, et al. Involved-field radiotherapy for advanced Hodgkin’s lymphoma. N Engl J Med. 2003; 348(24): 2396-406.(1iiDiii)
2) Borchmann P, et al. Eight cycles of escalated-dose BEACOPP compared with four cycles of escalated-dose BEACOPP followed by four cycles of baseline-dose BEACOPP with or without radiotherapy in patients with advanced-stage hodgkin’s lymphoma: final analysis of the HD12 trial of the German Hodgkin Study Group. J Clin Oncol. 2011; 29(32): 4234-42.(1iiDiii)
3) Fabian CJ, et al. Low-dose involved field radiation after chemotherapy in advanced Hodgkin disease. A Southwest Oncology Group randomized study. Ann Intern Med. 1994; 120(11): 903-12.(1iiA)
4) Johnson PW, et al. Consolidation radiotherapy in patients with advanced Hodgkin’s lymphoma: survival data from the UKLG LY09 randomized controlled trial(ISRCTN97144519). J Clin Oncol. 2010; 28(20): 3352-9.(3iiiDiii)
5) Laskar S, et al. Consolidation radiation after complete remission in Hodgkin’s disease following six cycles of doxorubicin, bleomycin, vinblastine, and dacarbazine chemotherapy: is there a need? J Clin Oncol. 2004; 22(1): 62-8.(1iiA)
6) Fermé C, et al. Comparison of chemotherapy to radiotherapy as consolidation of complete or good partial response after six cycles of chemotherapy for patients with advanced Hodgkin’s disease: results of the groupe d’études des lymphomes de l’Adulte H89 trial. Blood. 2000; 95(7): 2246-52.(1iiDii)
7) Specht L, et al. Modern radiation therapy for Hodgkin lymphoma: field and dose guidelines from the international lymphoma radiation oncology group(ILROG). Int J Radiat Oncol Biol Phys. 2014; 89(4): 854-62.
8) Wirth A, et al. Involved Site Radiation Therapy in Adult Lymphomas: An Overview of International Lymphoma Radiation Oncology Group Guidelines. Int J Radiat Oncol Biol Phys. 2020; 107(5): 909-33.(3iiiDiii)
9) Kobe C, et al. Positron emission tomography has a high negative predictive value for progression or early relapse for patients with residual disease after first-line chemotherapy in advanced-stage Hodgkin lymphoma. Blood. 2008; 112(10): 3989-94.(1iiDiii)
10)Engert A, et al. Reduced-intensity chemotherapy and PET-guided radiotherapy in patients with advanced stage Hodgkin’s lymphoma(HD15 trial): a randomised, open-label, phase 3 non-inferiority trial. Lancet. 2012; 379(9828): 1791-9.(1iiDiii)
11)Gallamini A, et al. Consolidation Radiotherapy Could Be Safely Omitted in Advanced Hodgkin Lymphoma With Large Nodal Mass in Complete Metabolic Response After ABVD: Final Analysis of the Randomized GITIL/FIL HD0607 Trial. J Clin Oncol. 2020; 38(33): 3905-13.(1iiDiii)
12)Ricardi U, et al. Role of radiotherapy to bulky sites of advanced Hodgkin lymphoma treated with ABVD: final results of FIL HD0801 trial. Blood Adv. 2021; 5(21): 4504-14.(1iiDi)
CQ10 再発・難治性CHLに対してどのような治療が勧められるか
- 推奨グレード
- カテゴリー2B
年齢を含む自家移植の適応,先行治療による奏効期間や有害事象などを考慮のうえ,従来の救援化学療法(ICE,GDP,DHAP,CHASE,ゲムシタビン単独療法など)や抗CD30抗体薬物複合体(ブレンツキシマブ ベドチン)あるいは抗PD-1抗体(ニボルマブ,ペムブロリズマブ)を選択する。
解説
再発・難治性CHLに対する,救援化学療法レジメンの選択肢としては,従来の化学療法(ICE 1),GDP 2),DHAP 3),CHASE 4),ゲムシタビン単剤療法5)など)や抗CD30抗体薬物複合体[ブレンツキシマブ ベドチン6-9)(BV)]あるいは抗PD-1抗体[ニボルマブ10-14)(NIVO),ペムブロリズマブ15-18)(PEM)]が挙げられる。救援化学療法レジメンの優劣を比較するエビデンスは極めて限られており18),いずれのレジメンを選択するかは,年齢を含む自家移植の適応,先行治療による奏効期間や有害事象,救援化学療法の目的などを考慮し決定する。
初回再発・難治性で,若年者(60歳未満)CHLに対する救援化学療法については,CQ11およびCQ12を参照する。
初回再発・難治性で,移植適応のないCHLに対する救援療法において,その目的は生存期間の延長や症状緩和であり,従来の化学療法よりもBVあるいはNIVO,PEMが選択されることが多い。
自家移植後再発あるは難治性CHLを対象とし,BV単剤療法(1.8mg/kg,3週ごと,最大16回まで)の第Ⅱ相試験では,主要評価項目である全奏効割合は75%,CR割合は34%であり,CR例の3年PFSおよびOSはそれぞれ58%,73%であった6-8)。主な有害事象は感覚性末梢神経障害,悪心,倦怠感,好中球減少および下痢であった。また,初回再発・難治性の高齢者(60歳以上)CHLを対象としたBV単剤療法の第Ⅱ相試験では,全奏効割合およびCR割合はそれぞれ53%と24%で,観察期間中央値24.9カ月時点でPFSおよびOSの中央値はそれぞれ8.8カ月および21.7カ月であった9)。高齢者におけるBV単剤療法の奏効持続期間は限定的であり,感染症や末梢神経障害など有害事象の発症により忍容性が低いことが報告された。
自家移植後再発したCHLを対象とし,NIVO単剤療法(3mg/kg,2週ごと,増悪まで)の第Ⅱ相試験では,主要評価項目である全奏効割合は69%で,奏効期間中央値は16.6カ月であった12)。Grade 3以上の治療関連有害事象としてリパーゼ上昇,好中球減少およびALT上昇が報告された。また,日本人の再発・難治性CHL 17例を対象とした,NIVO単剤療法の第Ⅱ相試験では,全奏効割合は88%,奏効期間中央値は8.5カ月であった13,14)。年齢中央値63歳と比較的高齢な対象集団であり,肺障害など一定の有害事象を認めたが,安全に投与可能であった。
再発・難治性CHLを対象とし,PEM単剤療法(200mg/body,3週ごと,最大2年間)の第Ⅱ相試験では,全奏効割合は72%,CR割合は28%で,全体の奏効期間中央値は16.5カ月であった16,17)。また,自家移植非適応あるいは自家移植後の再発・難治性CHLを対象とし,PEM単剤およびBV単剤の治療効果を比較するランダム化比較試験が実施され,観察期間中央値25.7カ月時点で,PEM群およびBV群のPFS中央値はそれぞれ13.2カ月,8.3カ月と統計学的有意差を認めた(OSについては未解析)18)。Grade 3以上の有害事象として,PEM群に肺臓炎,BV群に好中球減少および末梢神経障害が多い傾向を認めた。
また,同種造血幹細胞移植前後の抗PD-1抗体の使用により急性GVHDを含む免疫関連合併症のリスクを高めることが報告されており19,20),若年者CHLの救援化学療法レジメン選択においては重要な留意事項である。
参考文献
1) Moskowitz CH, et al. A 2-step comprehensive high-dose chemoradiotherapy second-line program for relapsed and refractory Hodgkin disease: analysis by intent to treat and development of a prognostic model. Blood. 2001; 97(3): 616-23.(3iiiDiv)
2) Baetz T, et al. Gemcitabine, dexamethasone and cisplatin is an active and non-toxic chemotherapy regimen in relapsed or refractory Hodgkin’s disease: a phase II study by the National Cancer Institute of Canada Clinical Trials Group. Ann Oncol. 2003; 14(12): 1762-7.(3iiiDiv)
3) Josting A, et al. Cologne high-dose sequential chemotherapy in relapsed and refractory Hodgkin lymphoma: results of a large multicenter study of the German Hodgkin Lymphoma Study Group(GHSG). Ann Oncol. 2005; 16(1): 116-23.(3iiiDiv)
4) Ogura M, et al. Pilot phase I/II study of new salvage therapy(CHASE)for refractory or relapsed malignant lymphoma. Int J Hematol. 2003; 77(5): 503-11.(3iiiDiv)
5) Santoro A, et al. Gemcitabine in the treatment of refractory Hodgkin’s disease: results of a multicenter phase II study. J Clin Oncol. 2000; 18(13): 2615-9.(2Div)
6) Younes A, et al. Results of a pivotal phase II study of brentuximab vedotin for patients with relapsed or refractory Hodgkin’s lymphoma. J Clin Oncol. 2012; 30(18): 2183-9.(2Div)
7) Gopal AK, et al. Durable remissions in a pivotal phase 2 study of brentuximab vedotin in relapsed or refractory Hodgkin lymphoma. Blood. 2015; 125(8): 1236-43.(2Div)
8) Chen R, et al. Five-year survival and durability results of brentuximab vedotin in patients with relapsed or refractory Hodgkin lymphoma. Blood. 2016; 128(12): 1562-6.(2Div)
9) Stefoni V, et al. Brentuximab vedotin in the treatment of elderly Hodgkin lymphoma patients at first relapse or with primary refractory disease: a phase II study of FIL ONLUS. Haematologica. 2020; 105(10): e512.(2Div)
10)Ansell SM, et al. PD-1 blockade with nivolumab in relapsed or refractory Hodgkin’s lymphoma. N Engl J Med. 2015; 372(4): 311-9.(2Div)
11)Younes A, et al. Nivolumab for classical Hodgkin’s lymphoma after failure of both autologous stem-cell transplantation and brentuximab vedotin: a multicentre, multicohort, single-arm phase 2 trial. Lancet Oncol. 2016; 17(9): 1283-94.(2Div)
12)Armand P, et al. Nivolumab for Relapsed/Refractory Classic Hodgkin Lymphoma After Failure of Autologous Hematopoietic Cell Transplantation: Extended Follow-Up of the Multicohort Single-Arm Phase II CheckMate 205 Trial. J Clin Oncol. 2018; 36(14): 1428-39.(2Div)
13)Maruyama D, et al. Multicenter phase II study of nivolumab in Japanese patients with relapsed or refractory classical Hodgkin lymphoma. Cancer Sci. 2017; 108(5): 1007-12.(2Div)
14)Maruyama D, et al. Final results of a phase II study of nivolumab in Japanese patients with relapsed or refractory classical Hodgkin lymphoma. Jpn J Clin Oncol 2020; 50(11): 1265-73.(2Div)
15)Armand P, et al. Programmed Death-1 Blockade With Pembrolizumab in Patients With Classical Hodgkin Lymphoma After Brentuximab Vedotin Failure. J Clin Oncol. 2016; 34(31): 3733-9.(2Div)
16)Chen R, et al. Phase II Study of the Efficacy and Safety of Pembrolizumab for Relapsed/Refractory Classic Hodgkin Lymphoma. J Clin Oncol. 2017; 35(19): 2125-32.(2Div)
17)Chen R, et al. Pembrolizumab in relapsed or refractory Hodgkin lymphoma: 2-year follow-up of KEYNOTE-087. Blood. 2019; 134(14): 1144-53.(2Div)
18)Kuruvilla J, et al. Pembrolizumab versus brentuximab vedotin in relapsed or refractory classical Hodgkin lymphoma(KEYNOTE-204): an interim analysis of a multicentre, randomised, open-label, phase 3 study. Lancet Oncol. 2021; 22(4): 512-24.(1iiDiii)
19)Herbaux C, et al. Efficacy and tolerability of nivolumab after allogeneic transplantation for relapsed Hodgkin lymphoma. Blood. 2017; 129(18): 2471-8.(3iiiDiv)
20)Haverkos BM, et al. PD-1 blockade for relapsed lymphoma post-allogeneic hematopoietic cell transplant: high response rate but frequent GVHD. Blood. 2017; 130(2): 221-8.(3iiiDiv)
CQ11 若年者(60歳未満)再発CHLに対して自家造血幹細胞移植併用大量化学療法は勧められるか
- 推奨グレード
- カテゴリー2A
若年者初回再発CHLでは,救援化学療法が奏効した場合,自家造血幹細胞移植併用大量化学療法は推奨される。
解説
再発CHLに対する通常量の救援化学療法と自家造血幹細胞移植併用大量化学療法(high-dose chemotherapy with autologous hematopoietic stem cell transplantation:HDC/AHSCT)との比較に関する臨床試験結果が報告されている。GHSGとEuropean Group for Blood and Marrow Transplantation(EBMT)の共同研究として,救援化学療法Dexa-BEAM 療法[DEX,BCNU(国内未承認),ETP,AraC,MEL]を4コース施行する群とDexa-BEAM療法2コース後にHDC/AHSCT(大量化学療法:BEAM療法を施行する群との比較試験が行われた1)。救援化学療法に感受性があると判断された症例を対象にした場合,FFTFはHDC/AHSCT群が有意に優れていた。OSには有意差は認められなかった。ただし,第二再発以降の症例ではHDC/AHSCTの優位性は示されていない。また,British Lymphoma National Investigation(BLNI)での通常救援化学療法とHDC/AHSCTの比較試験は,40例のみの登録で早期終了となっているが,EFSとPFSにおいてHDC/AHSCTが良好な傾向を示した2)。また,後方視的解析でHDC/AHSCTの有用性(初回再発または初回非奏効例)を示した研究3)や移植前の化学療法感受性がないと移植後の長期生存は難しいとする研究4)も報告されている。以上より,若年者(60歳未満)再発CHLの初回再発で救援化学療法が奏効した場合,HDC/AHSCTは推奨される治療法である。なお,移植適応の年齢上限については,65歳から70歳までとする施設が多く,70歳以上を対象とする場合には慎重に適応を判断すべきである。
また,移植後再発高リスク例(初回治療抵抗例,初回治療から1年以内の再発,あるいは救援化学療法前に節外病変を認める)を対象とし,HDC/AHSCT後にブレンツキシマブ ベドチン(BV)による地固め療法の意義を検証する二重盲検ランダム化比較試験の結果,プラセボ群に比べて,BV群のPFSは統計学的有意差をもって優れていた5)。ただし,プラセボ群は再発以降でBV投与が許容されており,OSは両群間で差がなかった。その後の5年フォローアップデータにおいても,自家移植後のBV投与(約1年間)の効果が長期間維持されることが示された6)。なお,本試験に登録された全例がBVの投与歴がなく,移植までにBVを含む治療が実施された症例に同様の効果が得られるのかはエビデンスがない。また,HDC/AHSCTに用いる前処置レジメンに関するエビデンスは限られており,欧米ではBEAM療法が汎用されている7)。
GHSGの後方視的解析では,限局期CHLからの再発,特に限局期の予後良好群からの再発例では,HDC/AHSCT未実施例でも予後良好とする報告がある8,9)。
以上より,初発時限局期で短縮化学療法を用いたCMTにより治療された症例の再発においては,HDC/AHSCTの有用性のエビデンスはないため,適応は慎重に判断されなければならない。
参考文献
1) Schmitz N, et al. Aggressive conventional chemotherapy compared with high-dose chemotherapy with autologous haemopoietic stem-cell transplantation for relapsed chemosensitive Hodgkin’s disease: a randomised trial. Lancet. 2002; 359(9323): 2065-71.(1iiDiii)
2) Linch DC, et al. Dose intensification with autologous bone-marrow transplantation in relapsed and resistant Hodgkin’s disease: results of a BNLI randomised trial. Lancet. 1993; 341(8852): 1051-4.(3iiiDi)
3) Yuen AR, et al. Comparison between conventional salvage therapy and high-dose therapy with autografting for recurrent or refractory Hodgkin’s disease. Blood. 1997; 89(3): 814-22.(3iiiA)
4) Sirohi B, et al. Long-term outcome of autologous stem-cell transplantation in relapsed or refractory Hodgkin’s lymphoma. Ann Oncol. 2008; 19(7): 1312-9.(3iiiA)
5) Moskowitz CH, et al. Brentuximab vedotin as consolidation therapy after autologous stem-cell transplantation in patients with Hodgkin’s lymphoma at risk of relapse or progression(AETHERA): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet. 2015; 385(9980): 1853-62.(1iDiii)
6) Moskowitz CH, et al. Five-year PFS from the AETHERA trial of brentuximab vedotin for Hodgkin lymphoma at high risk of progression or relapse. Blood. 2018; 132(25): 2639-42.(1iDiii)
7) Chen YB, et al. Impact of conditioning regimen on outcomes for patients with lymphoma undergoing high-dose therapy with autologous hematopoietic cell transplantation. Biol Blood Marrow Transplant. 2015; 21(6): 1046-53.(3iiiDiv)
8) Bröckelmann PJ, et al. Relapse After Early-Stage, Favorable Hodgkin Lymphoma: Disease Characteristics and Outcomes With Conventional or High-Dose Chemotherapy. J Clin Oncol. 2021; 39(2): 107-15.(3iiiDiii)
9) Bröckelmann PJ, et al. Clinical outcomes of relapsed and refractory Hodgkin lymphoma patients after contemporary first-line treatment: a German Hodgkin Study Group analysis. Leukemia. 2022; 36(3): 772-80.(3iiiDiii)
CQ12 若年者(60歳未満)初回再発後の再発CHLに対して自家造血幹細胞移植併用大量化学療法前の救援化学療法としてどのような治療が勧められるか
- 推奨グレード
- カテゴリー2B
初回治療奏効例においては,従来の救援化学療法(ICE,GDP,DHAP,ESHAP,CHASE療法など)が救援療法として勧められる。
一方,初回治療抵抗例あるいは従来の救援化学療法で十分な効果が得られない例においては,ブレンツキシマブ ベドチンあるいはニボルマブ,ペムブロリズマブが救援化学療法として勧められる。
解説
若年者(60歳未満)再発CHLの初回再発で救援化学療法が奏効した場合,自家造血幹細胞移植併用大量化学療法(HDC/AHSCT)は推奨される治療法であり,詳しくはCQ11を参照する。
CHLに対する初回治療が奏効した例(CRが得られ,少なくとも1年以上経過してからの再発例)においては,従来の救援化学療法(ICE1),GDP2),DHAP3),ESHAP4),CHASE 5)療法など)がHDC/AHSCT前の救援化学療法として勧められる。一方,CHLに対する初回治療抵抗例あるいは従来の救援化学療法で十分な効果が得られない例においては,ブレンツキシマブ ベドチン(BV)6)あるいはニボルマブ(NIVO)7),ペムブロリズマブ(PEM)6)がHDC/AHSCT前の救援化学療法として勧められる。
また,最近ではBV単剤療法を先行し,治療効果に応じて従来の救援化学療法を追加する方法8,9)や,BV同時併用化学療法(ICE 10),ESHAP 11),ベンダムスチン12),ゲムシタビン13))およびBV同時併用NIVO療法14,15)によるHDC/AHSCT前の救援化学療法の結果が報告されているが,BV同時併用レジメンは保険適用外かつ日本人のエビデンスは皆無であり,日常診療として実施すべきではない。
参考文献
1) Moskowitz CH, et al. A 2-step comprehensive high-dose chemoradiotherapy second-line program for relapsed and refractory Hodgkin disease: analysis by intent to treat and development of a prognostic model. Blood. 2001; 97(3): 616-23.(3iiiDiv)
2) Baetz T, et al. Gemcitabine, dexamethasone and cisplatin is an active and non-toxic chemotherapy regimen in relapsed or refractory Hodgkin’s disease: a phase II study by the National Cancer Institute of Canada Clinical Trials Group. Ann Oncol. 2003; 14(12): 1762-7.(3iiiDiv)
3) Josting A, et al. Time-intensified dexamethasone/cisplatin/cytarabine: an effective salvage therapy with low toxicity in patients with relapsed and refractory Hodgkin’s disease. Ann Oncol. 2002; 13(10): 1628-35.(3iiiDiv)
4) Aparicio J, et al. ESHAP is an active regimen for relapsing Hodgkin’s disease. Ann Oncol. 1999; 10(5): 593-5.(3iiiDiv)
5) Ogura M, et al. Pilot phase I/II study of new salvage therapy(CHASE)for refractory or relapsed malignant lymphoma. Int J Hematol. 2003; 77(5): 503-11.
6) Kuruvilla J, et al. Pembrolizumab versus brentuximab vedotin in relapsed or refractory classical Hodgkin lymphoma(KEYNOTE-204): an interim analysis of a multicentre, randomised, open-label, phase 3 study. Lancet Oncol. 2021; 22(4): 512-24.(1iiDiii)
7) Merryman RW, et al. Autologous stem cell transplantation after anti-PD-1 therapy for multiply relapsed or refractory Hodgkin lymphoma. Blood Adv. 2021; 5(6): 1648-59.(3iiiA)
8) Moskowitz AJ, et al. PET-adapted sequential salvage therapy with brentuximab vedotin followed by augmented ifosamide, carboplatin, and etoposide for patients with relapsed and refractory Hodgkin’s lymphoma: a non-randomised, open-label, single-centre, phase 2 study. Lancet Oncol. 2015; 16(3): 284-92.(3iiiDiv)
9) Chen R, et al. Results of a Multicenter Phase II Trial of Brentuximab Vedotin as Second-Line Therapy before Autologous Transplantation in Relapsed/Refractory Hodgkin Lymphoma. Biol Blood Marrow Transplant. 2015; 21(12): 2136-40.(3iiiDiv)
10)Lynch RC, et al. Dose-dense brentuximab vedotin plus ifosfamide, carboplatin, and etoposide for second-line treatment of relapsed or refractory classical Hodgkin lymphoma: a single centre, phase 1/2 study. Lancet Haematol. 2021; 8(8): e562-71.(3iiiDiv)
11)Garcia-Sanz R, et al. Brentuximab vedotin and ESHAP is highly effective as second-line therapy for Hodgkin lymphoma patients(long-term results of a trial by the Spanish GELTAMO Group). Ann Oncol. 2019; 30(4): 612-20.(3iiiDiv)
12)LaCasce AS, et al. Brentuximab vedotin plus bendamustine: a highly active first salvage regimen for relapsed or refractory Hodgkin lymphoma. Blood. 2018; 132(1): 40-8.(3iiiDiv)
13)Cole PD, et al. Brentuximab vedotin with gemcitabine for paediatric and young adult patients with relapsed or refractory Hodgkin’s lymphoma(AHOD1221): a Children’s Oncology Group, multicentre single-arm, phase 1-2 trial. Lancet Oncol. 2018; 19(9): 1229-38.(3iiiDiv)
14)Herrera AF, et al. Interim results of brentuximab vedotin in combination with nivolumab in patients with relapsed or refractory Hodgkin lymphoma. Blood. 2018; 131(11): 1183-94.(3iiiDiv)
15)Advani RH, et al. Brentuximab vedotin in combination with nivolumab in relapsed or refractory Hodgkin lymphoma: 3-year study results. Blood. 2021; 138(6): 427-38.(3iiiDiv)
CQ13 自家造血幹細胞移植併用大量化学療法後に再発したCHLに対して同種造血幹細胞移植は勧められるか
- 推奨グレード
- カテゴリー2B
自家造血幹細胞移植併用大量化学療法後に再発したCHLにおいて,救援化学療法が奏効した場合には,同種造血幹細胞移植が治療選択肢となり得る。しかし,その適応には十分な注意を要する。
解説
自家造血幹細胞移植併用大量化学療法(HDC/AHSCT)後に再発したCHLにおいて,救援化学療法が奏効した場合で,かつ臓器機能が保たれていれば,同種造血幹細胞移植(同種移植)は治癒が期待できる治療法として考慮すべき選択肢である1-6)。
同種移植においては,移植時の寛解状態7),既治療による臓器障害およびドナーソースの選択7-10)などの移植条件により,移植後再発および治療関連死亡のリスクが大きく異なるため,個々の症例で移植適応を考慮する必要がある。特に,欧米を中心として移植後大量シクロホスファミド(posttransplant cyclophosphamide:PTCY)を用いた,HLAハプロ一致血縁ドナーからの移植(ハプロ移植)の良好な成績が報告されている。なお,移植適応の年齢上限については,65~70歳とする施設が多く,70歳以上を対象とする場合には慎重に適応を判断すべきである。
CHLに対する同種移植においては,強度減弱前処置(reduced-intensity conditioning:RIC)あるいは骨髄非破壊的前処置(nonmyeloablative conditioning:NMA)を用いることで,移植関連死亡のリスク軽減につながる9-13)。
また,同種移植前後の抗PD-1抗体[ニボルマブ(NIVO)あるいはペムブロリズマブ(PEM)]の使用は,GVHDを含む移植後免疫関連有害事象のリスク上昇につながることが報告されている14-16)。また,同種移植前の抗PD-1抗体投与歴を有する例においては,ハプロ移植を問わず,PTCYを含むGVHD予防が有用であるとの報告がある17)。
参考文献
1) 平成30学会年度日本造血細胞移植学会ガイドライン委員会編集.造血細胞移植ガイドライン 悪性リンパ腫(成人)第3版.日本造血細胞移植学会. 2019.
2) Crump M. Management of Hodgkin lymphoma in relapse after autologous stem cell transplant. Hematology Am Soc Hematol Educ Program. 2008: 326-33.(3iiiA)
3) Kewalramani T, et al. Progressive disease following autologous transplantation in patients with chemosensitive relapsed or primary refractory Hodgkin’s disease or aggressive non-Hodgkin’s lymphoma. Bone Marrow Transplant. 2003; 32(7): 673-9.(3iiiA)
4) Sarina B, et al. Allogeneic transplantation improves the overall and progression-free survival of Hodgkin lymphoma patients relapsing after autologous transplantation: a retrospective study based on the time of HLA typing and donor availability. Blood. 2010; 115(18): 3671-7.(3iiiA)
5) Kako S, et al. The role of hematopoietic stem cell transplantation for relapsed and refractory Hodgkin lymphoma. Am J Hematol. 2015; 90(2): 132-8.
6) Rashidi A, et al. Allogeneic hematopoietic stem cell transplantation in Hodgkin lymphoma: a systematic review and meta-analysis. Bone Marrow Transplant. 2016; 51(4): 521-8.(3iiiA)
7) Marcais A, et al. Impact of disease status and stem cell source on the results of reduced intensity conditioning transplant for Hodgkin’s lymphoma: a retrospective study from the French Society of Bone Marrow Transplantation and Cellular Therapy(SFGM-TC). Haematologica. 2013; 98(9): 1467-75.(3iiiA)
8) Thompson PA, et al. Double umbilical cord blood transplant is effective therapy for relapsed or refractory Hodgkin lymphoma. Leuk Lymphoma. 2016; 57(7): 1607-15.(3iiiA)
9) Ahmed S, et al. Lower Graft-versus-Host Disease and Relapse Risk in Post-Transplant Cyclophosphamide-Based Haploidentical versus Matched Sibling Donor Reduced-Intensity Conditioning Transplant for Hodgkin Lymphoma. Biol Blood Marrow Transplant. 2019; 25(9): 1859-68.(3iiiA)
10)Burroughs LM, et al. Comparison of outcomes of HLA-matched related, unrelated, or HLA-haploidentical related hematopoietic cell transplantation following nonmyeloablative conditioning for relapsed or refractory Hodgkin lymphoma. Biol Blood Marrow Transplant. 2008; 14(11): 1279-87.(3iiiA)
11)Sureda A, et al. Reduced-intensity conditioning compared with conventional allogeneic stem-cell transplantation in relapsed or refractory Hodgkin’s lymphoma: an analysis from the Lymphoma Working Party of the European Group for Blood and Marrow Transplantation. J Clin Oncol. 2008; 26(3): 455-62.(3iiiA)
12)Robinson SP, et al. Reduced intensity conditioning allogeneic stem cell transplantation for Hodgkin’s lymphoma: identification of prognostic factors predicting outcome. Haematologica. 2009; 94(2): 230-8.(3iiiA)
13)Sureda A, et al. Allogeneic stem cell transplantation after reduced intensity conditioning in patients with relapsed or refractory Hodgkin’s lymphoma. Results of the HDR-ALLO study - a prospective clinical trial by the Grupo Español de Linfomas/Trasplante de Médula Osea(GEL/TAMO)and the Lymphoma Working Party of the European Group for Blood and Marrow Transplantation. Haematologica. 2012; 97(2): 310-7.(3iiiA)
14)Merryman RW, et al. Safety and efficacy of allogeneic hematopoietic stem cell transplant after PD-1 blockade in relapsed/refractory lymphoma. Blood. 2017; 129(10): 1380-8.(3iiiA)
15)Herbaux C, et al. Efficacy and tolerability of nivolumab after allogeneic transplantation for relapsed Hodgkin lymphoma. Blood. 2017; 129(18): 2471-8.(3iiiDiv)
16)Haverkos BM, et al. PD-1 blockade for relapsed lymphoma post-allogeneic hematopoietic cell transplant: high response rate but frequent GVHD. Blood. 2017; 130(2): 221-8.(3iiiDiv)
17)Merryman RW, et al. Allogeneic transplantation after PD-1 blockade for classic Hodgkin lymphoma. Leukemia. 2021; 35(9): 2672-83.(3iiiA)

