第Ⅰ章 白血病
Ⅰ 白血病
5 慢性リンパ性白血病 / 小リンパ球性リンパ腫
(chronic lymphocytic leukemia/small lymphocytic lymphoma:CLL/SLL)
総論
慢性リンパ性白血病(chronic lymphocytic leukemia:CLL)は,単一な小型円形から軽度の異型を持つBリンパ球の腫瘍で,CD5とCD23の発現がみられ,日本では稀な腫瘍である。小リンパ球性リンパ腫(small lymphocytic lymphoma:SLL)は末梢血や骨髄への浸潤がないCLLと同一の細胞の腫瘍と定義される1)。
多くは緩徐な経過を示すが,一部に進行が速く,予後不良なものがみられる。病期分類にて病期を決定し,治療開始規準に準じて治療を実施する。初回治療では,ブルトン型チロシンキナーゼ(Bruton’s tyrosine kinase:BTK)阻害薬が標準治療である。再発では,過去の治療薬に応じてBTK阻害薬,BCL-2阻害薬とリツキシマブ(R)併用療法,適応例では同種移植を考慮する。分子標的治療が適応とならない場合を除き,初回治療であっても免疫化学療法は選択されなくなった2-4)。
1.病期分類
治療方針の決定に必須で,米国では改訂Rai分類,欧州ではBinet分類(表1)5,6)が使用される。診察所見と貧血,血小板減少で評価するが,実臨床では胸部X線検査や,適宜腹部超音波検査,CT検査を行い,活動性病態(表2)1)を評価する。SLLの病期分類は,悪性リンパ腫の病期分類に準ずる。改訂Rai分類で高リスク,Binet分類でC期となれば治療を考慮する。
表1-1 改訂Raiの病期分類
| 改訂Rai分類 | Rai分類病期 | 分類規準 |
|---|---|---|
| 低リスク | 0 | 末梢血モノクローナルBリンパ球>5,000/μL+骨髄リンパ球>40% |
| 中間リスク | Ⅰ | 病期0+リンパ節腫脹 |
| Ⅱ | 病期0~Ⅰ+肝腫,脾腫(どちらかまたは両方) | |
| 高リスク | Ⅲ | 病期0~Ⅱ+貧血(Hb<11g/dLまたはHt<33%) |
| Ⅳ | 病期0~Ⅲ+血小板<10万/μL |
(文献5)より引用)
表1-2 Binetの病期分類
| 病期 | 分類規準 |
|---|---|
| A | Hb≧10g/dL+血小板≧10万/μL+リンパ領域腫大が2カ所以下 |
| B | Hb≧10g/dL+血小板≧10万/μL+リンパ領域腫大が3カ所以上 |
| C | Hb<10g/dLまたは血小板<10万/μL,リンパ節腫大領域数は規定しない |
(文献6)より引用)
表2 International Workshop on Chronic Lymphocytic Leukemiaで示された治療開始規準
1)骨髄不全の出現もしくは増悪(通常Hb<10g/dLまたは血小板<10万/μL)
2)左肋骨弓下6cm以上の脾腫,進行性または症候性の脾腫
3)長径10cm以上のリンパ節塊,進行性または症候性のリンパ節腫脹
4)2カ月以内に50%を超える進行性リンパ球増加,6カ月以下のリンパ球倍加時間
5)副腎皮質ステロイド抵抗性の自己免疫性貧血や血小板減少症
6)症候性または機能的な問題を生じる髄外病変(皮膚,腎臓,肺,脊髄など)
7)CLLに起因する以下のいずれかの症状のあるとき
①減量によらない過去6カ月以内の10%以上の体重減少
②労働や日常生活が困難である(ECOG PS 2以上)の倦怠感
③感染症の所見なしに2週間以上続く38℃以上の発熱
④感染症の所見なしに1カ月以上続く寝汗
(文献1)より引用)
2.予後因子
1)病期
Rai分類が報告されたのは1975年であり,概ねCLLの自然経過を反映していると考えられる。診断後の生存期間中央値は,0期が150カ月,I期が101カ月,II期が71カ月,そして高リスク群であるⅢ期とⅣ期はいずれも19カ月と,高リスク群で生存予後が悪化する5)。1985年に報告されたBinet分類でも,A期が10年以上,B期が7年の生存期間中央値を示すのに対し,C期は2年と予後不良である6)。
2)p53異常(17p欠失もしくはTP53変異)
17p欠失もしくはTP53変異がみられる場合,免疫化学療法の効果は期待できない2-4)。p53異常は新規分子標的治療後のPFSにも悪影響を及ぼすが7-9),BTK阻害薬を初回治療で用いた場合に限れば,強い影響を与えない10,11)。
3)免疫グロブリン重鎖可変部体細胞遺伝子変異(somatic hypermutation of the immunoglobulin heavy chain variable region:IGHV)ステータス(保険適用外)
IGHV変異なし(unmutated IGHVステータス)は,免疫化学療法を受けた患者の生存予後およびBCL-2阻害薬治療後のPFSを低下させる因子である9,12)。BTK阻害薬の有効性には悪影響を及ぼさない7)。IGHV変異ステータスは腫瘍の由来を反映し,一般にIGHV変異なし例で病勢進行が速い。さらに,IGHV変異のない例では,TP53,ATM,NOTCH1などの免疫化学療法抵抗性と関係する遺伝子変異が高頻度に起きる13)。IGHV変異ステータス検査は保険適用がないので,サロゲート・マーカーとしてCD38,ZAP70,CD49d発現を用いる方法もあるが,必ずしも適中率は高くない2)。
4)Physical fitness
ECOGのperformance status(PS)以外にも,併存疾患指数(cumulative illness rating scale:CIRS)などの高齢者機能評価を用い,標準治療が実施可能な“fit”群,標準治療が推奨されない“unfit”,そしてbest supportive care(BSC)が考慮される“frail”に分類する2,3)。高齢者機能評価のなかでも併存疾患によりOSが異なることが報告されている14)。
5)その他の予後因子
免疫化学療法時代の予後因子として,International prognostic index for patients with chronic lymphocytic leukaemia(CLL-IPI)がある。初回治療として免疫化学療法を受けた3,000例以上を対象にOSを検証した結果,4つのグループに層別化可能された15)。これは5つの因子(p53異常:4点,IGHV変異なし:2点,血清β2ミクログロブリン>3.5mg/L:2点,臨床病期Binet分類A期およびRai分類0期以外:1点,年齢>65歳:1点)を10点満点でスコア化したもので,5年OSがlowリスク(0~1点)93.2%(95%CI:90.5-96.0),intermediateリスク(2~3点)79.3%(95%CI:75.5-83.2),highリスク(4~6点)63.3%(95%CI:57.9-68.8),very highリスク(7~10点)23.3%(95%CI:12.5-34.1)であった15)。
BTK阻害薬について,イブルチニブ(IBT)治療の予後因子(Four-Factor Score)が報告されている16)。既治療例,p53異常(17p欠失もしくはTP53変異)ありβ2ミクログロブリン>5mg/L,LDH高値の4項目が予後不良因子であり,0~1項目を持つものを低リスク,2項目を中間リスク,3項目以上を高リスクに分類している。3年OSは低リスクで93%,中間リスクで83%,高リスクで63%であった。p53異常のみでは低リスクに分類され,単独ではOS・PFSに悪影響を与えていない。
3.治療
CLLは経過の長い疾患で,診断後すぐに治療を行わなくても日常生活に影響しないことが多い。また高齢な患者が多く,治療関連死亡のリスクが高いため,治療開始時期は慎重に判断する2,3)。活動性病変のない早期CLL患者(改訂Rai分類の低または中間リスク,Binet分類のAまたはB期)は,早期に治療を行っても生存期間は延長しないため,治療を開始せず経過観察を行う(CQ1)。進行期CLL患者(改訂Rai分類の高リスク,Binet分類のC期),もしくはCLLに起因する全身症状や血球減少,症候性,進行性の肝脾腫やリンパ節腫脹,急速なリンパ球増加,ステロイド抵抗性の自己免疫性血球減少症などが出現した場合に治療を開始する(CQ7)。白血球(リンパ球)数に治療開始規準となる閾値はない。International Workshop on Chronic Lymphocytic Leukemia(iwCLL)が提唱している治療開始規準を表2に示す1)。
治療レジメンは,CLLの特徴および患者の状態を考慮して選択する。17p欠失やTP53変異をもつCLLは,抗がん薬や抗CD20抗体薬治療に抵抗性である(CQ3,6)。高齢者や全身状態が悪い,あるいは高齢者機能評価に問題があるunfitな患者は,標準治療を行うと治療関連毒性が強く現れる危険性が高い。そのため従来は染色体/遺伝子異常,年齢,全身状態,高齢者機能評価に基づいて治療法が層別化されていた。しかし,BTK阻害薬は17p欠失もしくはTP53変異を認めるCLL患者にも有効で,高齢者でも優れた効果と高い忍容性が得られることが臨床試験で示され,染色体/遺伝子異常や年齢にかかわらず初回治療としてBTK阻害薬が推奨されるようになった(CQ2)。frailな患者は,BSCの選択を含めて対応を検討する。
再発時は,染色体/遺伝子異常の有無や年齢,全身状態,高齢者機能評価に加えて,前治療の効果(抵抗性)と治療関連毒性(忍容性),前治療終了後から再発までの期間を考慮して,治療レジメンを選択する(CQ4~6)。
経過中に組織学的形質転換(Richter症候群)を起こすと,急激に病勢が進行する。びまん性大細胞型B細胞リンパ腫に転換することが大半で,一部はホジキンリンパ腫に転換する。生検を施行して病理学的に診断し,組織型に基づいた治療を行う(CQ8)。
同種造血幹細胞移植はCLLに対する唯一の根治的治療で,予後不良と考えられるRichter症候群や,高リスク染色体/遺伝子異常をもつCLLに対して行われている(CQ8,9)。BTK阻害薬,BCL-2阻害薬など新規薬剤が標準治療になり,CAR-T療法など新しい免疫療法の開発が進んでおり,同種移植の適応となるCLL症例は減少している。
4.治療効果判定
治療効果の判定は,iwCLLが提唱している規準に従い腫瘍量と全身症状(グループA)および造血機能(グループB)を評価して行う(表3)1)。評価時期は,限定された期間治療を行う場合は治療終了後2カ月以上,継続治療の場合は最大治療効果が得られて2カ月以上経ってから行う。
表3 International Workshop on Chronic Lymphocytic Leukemiaで示された治療効果判定規準
| グループ | 項目 | CR | PR | PD | SD |
|---|---|---|---|---|---|
| A | リンパ節 | 1.5cm以上のリンパ節なし | 治療前に比べて50%以下に縮小* | 治療前または奏効時に比べて50%以上増大 | 大きさの変化が−49%~49% |
| 肝脾の大きさ** |
脾の大きさが13cm未満 肝の大きさが正常 |
治療前に比べて50%以下に縮小 | 治療前または奏効時に比べて50%以上増大 | 大きさの変化が−49%~49% | |
| 全身症状 | なし | 有無を問わず | 有無を問わず | 有無を問わず | |
| 末梢血リンパ球数 | 正常 | 治療前に比べて50%以下に減少 | 治療前に比べて50%以上増加 | 数値の変化が−49%~49% | |
| B | 血小板数 | 10万/μL以上 | 10万/μL以上または治療前に比べて50%以上増加 | CLLの影響で治療前に比べて50%以下に減少 | 数値の変化が−49%~49% |
| ヘモグロビン | 11.0g/dL以上(輸血なし,EPO製剤の投与なし) | 11.0g/dL以上または治療前に比べて50%以上増加 | CLLの影響で治療前に比べて50%以下に減少 | 数値の変化が−49%~49% | |
| 骨髄 | 正形成,CLL細胞の浸潤なし,B-リンパ濾胞なし | CLL細胞浸潤またはB-リンパ濾胞あり,または未検査 | 骨髄生検でCLL細胞が50%以上増加 | 骨髄浸潤に変化なし |
*診察もしくはCTで測定した6個以下のリンパ節のサイズの総和
**脾臓サイズが13cm未満の場合は正常と判断する。肝臓サイズに関する国際的に合意された基準はないため,臨床試験では診察もしくは画像を用いた規準を定めて評価する。
CR(complete remission):全項目を満たす。
PR(partial remission):治療前に異常であったグル−プAの2項目およびグル−プBの1項目を満たす。治療前にグループAおよびグループBともに1項目が異常であった場合は,1項目を満たす。
PD(progressive disease):グループAまたはグループBの1項目以上を満たす。
SD(stable disease):全項目を満たす。全身症状のみ認める場合はPDとはしない。
(文献1)より作成)
BTK阻害薬治療では一過性に末梢血のリンパ球数が増加する。リンパ球増加が遷延することがあるが,予後には影響しないことが知られている。そのためBTK阻害薬治療時は,リンパ節腫脹や肝脾腫,全身症状,血液所見は改善したが,リンパ球数増加のみが持続する場合は,PR with lymphocytosis(PR-L)と判定する17)。
BTK阻害薬やBCL-2阻害薬など新規治療薬を用いた治療では,優れた奏効が得られ,生存期間が延長する。奏効の程度をより詳細に調べる目的で,臨床試験ではMRDの測定が治療効果の評価に用いられている。マルチカラーフローサイトメトリーおよび定量PCRでは,10-4~10-5レベルでMRDを検出できる18,19)。最も感度が高いのは次世代シーケンサーを用いた解析で,10-6レベルまで検出可能である20)。MRDが陰性(測定感度以下)になることは良好な予後予測因子であることが,複数の臨床試験で報告されている9,21,22)。
参考文献
1) Hallek M, et al. iwCLL guidelines for diagnosis, indications for treatment, response assessment, and supportive management of CLL. Blood. 2018; 131(25): 2745-60.(ガイドライン)
2) NCCN Clinical Practice Guidelines in Oncology. Chronic Lymphocytic Leukemia/Small Lymphocytic Lymphoma. Version 3.2022.(ガイドライン)
3) Eichhorst B, et al. Chronic lymphocytic leukaemia: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2021; 32(1): 23-33.(ガイドライン)
4) Kojima K, et al. Treatment algorithm for Japanese patients with chronic lymphocytic leukemia in the era of novel targeted therapies. J Clin Exp Hematop. 2020; 60(4): 130-7.(ガイドライン)
5) Rai KR, et al. Clinical staging of chronic lymphocytic leukemia. Blood. 1975; 46(2): 219-34.(3iiA)
6) Binet JL, et al. A new prognostic classification of chronic lymphocytic leukemia derived from a multivariate survival analysis. Cancer. 1981; 48(1): 198-206.(3iiA)
7) Byrd JC, et al. Ibrutinib Treatment for First-Line and Relapsed/Refractory Chronic Lymphocytic Leukemia: Final Analysis of the Pivotal Phase Ib/II PCYC-1102 Study. Clin Cancer Res 2020; 26(15): 3918-27.(3iiiDiv)
8) Al-Sawaf O, et al. Minimal Residual Disease Dynamics after Venetoclax-Obinutuzumab Treatment: Extended Off-Treatment Follow-up From the Randomized CLL14 Study. J Clin Oncol. 2021; 39(36): 4049-60.(1iiADiii)
9) Kater AP, et al. Venetoclax Plus Rituximab in Relapsed Chronic Lymphocytic Leukemia: 4-Year Results and Evaluation of Impact of Genomic Complexity and Gene Mutations From the MURANO Phase III Study. J Clin Oncol 2020; 38(34): 4042-54.(1iiADiii)
10)Ahn IE, et al. Ibrutinib for Chronic Lymphocytic Leukemia with?TP53 Alterations. N Engl J Med 2020; 383(5): 498-500.(3iiiDiv)
11)Sharman JP, et al. Acalabrutinib with or without obinutuzumab versus chlorambucil and obinutuzmab for treatment-naive chronic lymphocytic leukaemia(ELEVATE TN): a randomised, controlled, phase 3 trial. Lancet. 2020; 395(10232): 1278-91.(1iiADiii)
12)Rossi D, et al. Molecular prediction of durable remission after first-line fludarabine-cyclophosphamide-rituximab in chronic lymphocytic leukemia. Blood. 2015; 126(16): 1921-4.(3iiiDiii)
13)Leeksma AC, et al. Clonal diversity predicts adverse outcome in chronic lymphocytic leukemia. Leukemia. 2019; 33(2): 390-402.(3iii)
14)Goede V, et al. Interactions between comorbidity and treatment of chronic lymphocytic leukemia: results of German Chronic Lymphocytic Leukemia Study Group trials. Haematologica. 2014; 99(6): 1095-100.(3iiA)
15)International CLL-IPI working group. An international prognostic index for patients with chronic lymphocytic leukaemia(CLL-IPI): a meta-analysis of individual patient data. Lancet Oncol. 2016; 17(6): 779-90.(1iiA)
16)Ahn IE, et al. Prediction of Outcome in Patients With Chronic Lymphocytic Leukemia Treated With Ibrutinib: Development and Validation of a Four-Factor Prognostic Model. J Clin Oncol. 2021; 39(6): 576-85.(3iiiADiii)
17)Cheson BD, et al. Novel targeted agents and the need to refine clinical end points in chronic lymphocytic leukemia. J Clin Oncol. 2012; 30(23): 2820-2.(レビュー)
18)Rawstron AC, et al. Improving efficiency and sensitivity: European Research Initiative in CLL(ERIC)update on the international harmonised approach for flow cytometric residual disease monitoring in CLL. Leukemia. 2013; 27(1): 142-9.(3iiiD)
19)Rawstron AC, et al. A complementary role of multiparameter flow cytometry and high-throughput sequencing for minimal residual disease detection in chronic lymphocytic leukemia: an European Research Initiative on CLL study. Leukemia. 2016; 30(4): 929-36.(3iiiD)
20)Thompson PA, et al. Minimal residual disease undetectable by next-generation sequencing predicts improved outcome in CLL after chemoimmunotherapy. Blood. 2019; 134(22): 1951-9.(3iiiDiii)
21)Kovacs G, et al. Minimal Residual Disease Assessment Improves Prediction of Outcome in Patients With Chronic Lymphocytic Leukemia(CLL)Who Achieve Partial Response: Comprehensive Analysis of Two Phase III Studies of the German CLL Study Group. J Clin Oncol. 2016; 34(31): 3758-65.(1iiADiii)
22)Kater AP, et al. Venetoclax Plus Rituximab in Relapsed Chronic Lymphocytic Leukemia: 4-Year Results and Evaluation of Impact of Genomic Complexity and Gene Mutations From the MURANO Phase III Study. J Clin Oncol. 2020; 38(34): 4042-54.(1iiADiii)
アルゴリズム
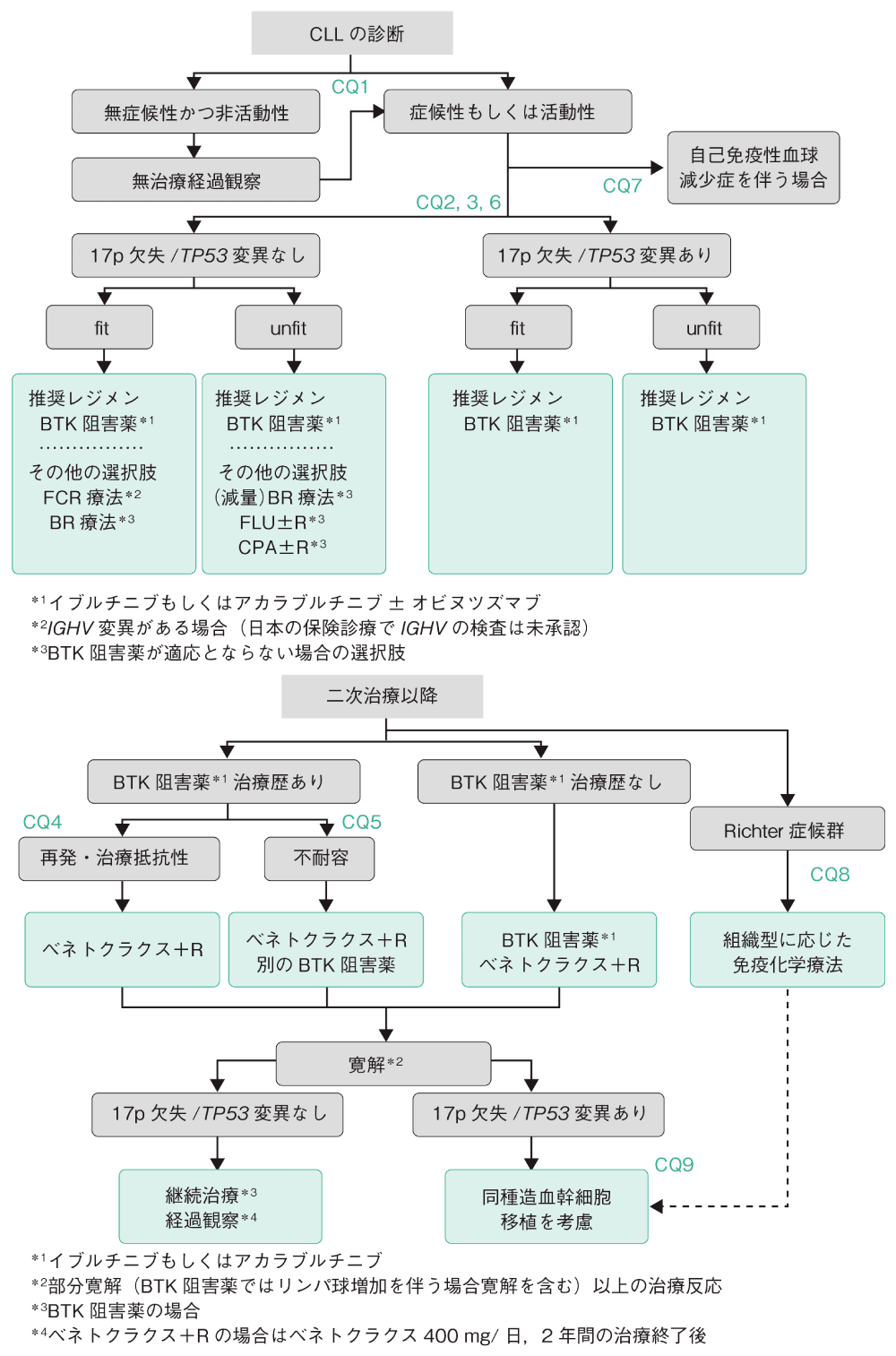
CLLと診断した場合,改訂Rai分類またはBinet分類(総論の表1)に基づいて病期分類を行い,活動性病態(総論の表2)がないか評価する。17p欠失(もしくはTP53変異),および可能であればIGHV変異の有無を調べる(保険適用外)。無症状で活動性の病態がないBinet病期分類AとB,Rai病期分類0~Ⅱの早期CLLには,治療を開始せず経過観察を行うことが推奨される(CQ1)。CLLに起因する症候もしくは血球減少,急速なリンパ球増加,進行性の肝脾腫やリンパ節腫脹,ステロイド抵抗性の自己免疫性血球減少症など活動性の病態が出現した場合に,治療を開始する(CQ7)。
治療を開始する際は,併存疾患指数などの高齢者機能評価を行い,physical fitnessを評価する。fitな患者には,標準治療を実施する。unfitな患者は,治療関連毒性が現れるリスクが高いことに注意する。frailな患者は,治療のメリットとデメリットを考え合わせ,BSCの選択を含めて対応を検討する。
CLL初回治療として,BTK阻害薬イブルチニブ(IBT)もしくはアカラブルチニブ±オビヌツズマブ療法が推奨される(CQ2,6)。BTK阻害薬は,17p欠失もしくはTP53変異があるCLLにも有効で,高齢者でも忍容性が高く,17p欠失もしくはTP53変異の有無,および年齢にかかわらず初回治療として推奨される。免疫化学療法は,IBTとの比較試験で治療成績が劣ることが確認されており,CLLに対する初回治療として推奨されない(CQ3,6)。ただしFCR療法(FLU,CPA,R)は,17p欠失がなく,かつIGHV変異のあるfitなCLLでは,IBTと同等の効果が得られる可能性があり,初回治療としてFCR療法は選択肢の一つである(CQ3)。
再発時は,前治療の効果(抵抗性)と治療関連毒性(忍容性)を考慮して,治療レジメンを選択する。初回治療(前治療)でIBT療法に抵抗性のCLLに対して,BCL-2阻害薬ベネトクラクス(VEN)+R療法が推奨される(CQ4)。IBT療法に不耐容のCLLに対しては,VEN+R療法,BTK阻害薬アカラブルチニブ療法が推奨される(CQ5)。前治療でIBTを使用していない再発CLLには,IBT,アカラブルチニブ,VEN+R療法が推奨される。
CLLは時に組織学的形質転換(Richter症候群)をきたし,急激な病勢進行を示す。生検を行って病理組織診断に応じた免疫化学療法が勧められる(CQ8)。
同種造血幹細胞移植はCLLに対する唯一の根治的治療で,CLLクローン由来のびまん性大細胞型B細胞リンパ腫など予後不良と考えられるRichter症候群や,BTK阻害薬,BCL-2阻害薬いずれにも抵抗性となったCLLに対して行われている(CQ8,9)。
CQ1 早期CLLに対して治療介入は勧められるか
- 推奨グレード
- カテゴリー1
無症状で活動性の病態がないBinet病期分類AとB,Rai病期分類0~Ⅱの早期CLLには,治療を開始せず経過観察を行うことが推奨される。
解説
Binet病期分類A,およびRai病期分類Ⅰ~ⅡのCLLを対象に,chlorambucil ±プレドニゾロンによる早期治療介入と遅延治療とを比較した6つのランダム化比較試験のメタアナリシスが行われている1)。早期治療群と遅延治療群の10年OSに有意差はなく(44% vs. 47%,difference −3%,95%CI −10%-4%),chlorambucilによる早期治療を行っても生存期間は延長しないことが示された。
Binet病期分類Aの中で進行するリスクが高い(びまん性骨髄浸潤パターンまたはリンパ球倍加速度<12カ月のいずれかを満たし,かつ血清チミジンキナーゼ>7.0U/Lまたはβ2ミクロブロブリン>3.5mg/Lを満たす)CLLを対象に,フルダラビン(FLU)と経過観察のランダム化比較試験が行われた2)。観察期間中央値8.5年で,PFSはFLU群で有意に延長したが,OSに差は認められなかった。
Binet病期分類Aで高リスク(リンパ球倍加速度<12カ月,血清チミジンキナーゼ>10U/L,IGHV変異なし,予後不良染色体異常[del(11q)/del(17p)/trisomy12の2つ以上を満たす]CLLを対象に,FCR療法(FLU,CPA,R)による早期治療の有用性を検証するランダム化比較試験が行われた3)。観察期間中央値55.6カ月で,FCR療法群の方が経過観察群に比べてEFSは有意に延長したが,OSの延長は認められなかった。
Binet病期Aで,GCLLSGスコアがIntermediate以上(年齢>60歳:1点,男性:1点,血清β2ミクログロブリン 1.7~3.5mg/L:1点,>3.5mg/L:2点,ECOG PS>0:1点,血清チミジンキナーゼ>10 U/L:2点,IGHV変異なし:1点,11q欠失:1点,17p欠失:6点とし,合計3点以上)のCLLを対象に,イブルチニブ(IBT)もしくはプラセボを内服するランダム化比較試験が行われた4)。観察期間中央値31.0カ月の時点で,主要評価項目のEFSはIBT群の方がプラセボ群に比べて有意に延長したが(HR 0.25,95%CI 0.14-0.43),OSに差は認められず,IBTによる早期治療介入の有用性は示されなかった。IBT群では,心房細動を含む不整脈(21.5%),出血イベント(33.5%)がプラセボ群(それぞれ7.7%と14.8%)に比べて高頻度に出現した。
以上の結果より,無症状で活動性の病態がないBinet病期分類A~B,Rai病期分類0~ⅡのCLLに対して早期治療介入を行っても生存期間の延長効果は得られず,経過観察が標準治療と考えられる5-7)。
参考文献
1) Chemotherapeutic options in chronic lymphocytic leukemia: a meta-analysis of the randomized trials. CLL Trialists’ Collaborative Group. J Natl Cancer Inst. 1999; 91(10): 861-8.(1iiA)
2) Hoechstetter MA, et al. Early, risk-adapted treatment with fludarabine in Binet stage A chronic lymphocytic leukemia patients: results of the CLL1 trial of the German CLL study group. Leukemia. 2017; 31(12): 2833-7.(1iiDiii)
3) Herling CD, et al. Early treatment with FCR versus watch and wait in patients with stage Binet A high-risk chronic lymphocytic leukemia(CLL): a randomized phase 3 trial. Leukemia. 2020; 34(8): 2038-50.(1iiDi)
4) Langerbeins P, et al. The CLL12 trial: ibrutinib vs placebo in treatment-naïve, early-stage chronic lymphocytic leukemia. Blood. 2022; 139(2): 177-87.(1iDi)
5) Hallek M, et al. Chronic lymphocytic leukemia: 2022 update on diagnostic and therapeutic procedures. Am J Hematol. 2021; 96(12): 1679-705.(ガイドライン)
6) Eichhorst B, et al. Chronic lymphocytic leukaemia: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2021; 32(1): 23-33.(ガイドライン)
7) Wierda WG, et al. Chronic Lymphocytic Leukemia/Small Lymphocytic Lymphoma, Version 4.2020, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw. 2020; 18(2): 185-217.(ガイドライン)
CQ2 CLL初回治療としてBTK阻害薬療法は勧められるか
- 推奨グレード
- カテゴリー1
CLL初回治療としてBTK阻害薬イブルチニブもしくはアカラブルチニブ±オビヌツズマブ療法が推奨される。
解説
染色体17p欠失もしくはTP53変異があるCLLは,免疫化学療法に抵抗性であるが,BTK阻害薬イブルチニブ(IBT)もしくはアカラブルチニブ±オビヌツズマブが有効であることが示されている1-5)。17p欠失もしくはTP53変異があるCLLに対する初回治療として,BTK阻害薬が推奨される。
17p欠失のない65歳以上の未治療CLL患者を対象に,chlorambucilとIBTとのランダム化比較試験が実施された6,7)。観察期間中央値60カ月の時点で,IBT群の方がchlorambucil群に比べてPFSおよびOS(5年OS 83% vs. 68%,HR 0.450,95%CI 0.266-0.761)が延長した。サブグループ解析では,年齢,性別,臨床病期,PS,予後不良リスク(TP53変異/11q欠失/IGHV変異陰性)にかかわらず,IBT群のPFSが優れていた。有害事象により治療を中止した割合は,IBT群(9%)の方がchlorambucil群(23%)より少なかった。IBT群では,高血圧が14%(Grade 3 4%),心房細動が6%(Grade 3 1.5%),Grade 3以上もしくは中枢神経系の出血が4%で起こった。本試験では高齢者機能評価が行われていないが,IBTはchlorambucilより忍容性が高く,かつ生存期間が延長する効果が得られ,高齢CLLに対する初回治療として推奨される。
17p欠失のない70歳以下の未治療CLL患者を対象に,免疫化学療法(FCR療法)とIBT+リツキシマブ(R)療法のランダム化比較試験が実施された8)。観察期間中央値33.6カ月の時点で,IBT+R療法の方がPFSおよびOS(3年OS 98.8% vs. 91.5%,HR 0.17,95%CI 0.05-0.54)が延長した。有害事象は,免疫化学療法群でGrade 3~4の好中球減少,感染症,IBT群でGrade 3~4の高血圧の頻度が高かった。IBT群では,Grade 3以上の出血(1.1%),心毒性(6.5%)が認められた。免疫化学療法の適応となるfitなCLLに対して,IBT療法は生存期間が延長する効果が得られ,初回治療として推奨される。以上より,染色体17p欠失もしくはTP53変異の有無,および年齢にかかわらず,CLL初回治療としてIBTが推奨される。
未治療CLLに対するIBTの追跡調査で,IBTを長期間継続すると経時的に深い奏効が得られる割合が増加することが示されている7)。IBTは病勢進行もしくは不耐容になるまで継続することが望ましい。
BTK阻害薬アカラブルチニブは,IBTに比べてより選択的にBTKを阻害する。未治療CLLに対してchlorambucil+オビヌツズマブ療法と,アカラブルチニブ単剤,アカラブルチニブ+オビヌツズマブ療法の3群を比較する臨床試験が実施された4,5)。アカラブルチニブ単剤群およびアカラブルチニブ+オビヌツズマブ群では,chlorambucil+オビヌツズマブ群に比べて有意にPFSが延長した。サブグループ解析で,IGHV変異なし,17p欠失もしくはTP53変異あり,11q欠失といった予後不良因子を持つ患者においてもアカラブルチニブ単剤群およびアカラブルチニブ+オビヌツズマブ群の優位性が認められた。観察期間中央値46.9カ月の時点でOSに有意な差は認められていない。この結果より,アカラブルチニブ±オビヌツズマブ療法は,CLLの初回治療として推奨される。
CLLに対してIBT単剤とIBT+R療法を比較する臨床試験が2つ行われている9,10)。Rを併用すると,末梢血リンパ球数が正常化する,あるいはCRが得られるまでの期間が短くなり,骨髄のMRDが減少するものの,奏効割合,PFSに差はみられず,IBT単剤が標準治療となっている。一方,アカラブルチニブとアカラブルチニブ+オビヌツズマブ療法の比較試験では,post hoc解析でオビヌツズマブを併用した方がCR割合およびPFSが優れていた4,5)。IBTはCLL細胞のCD20発現を減弱し,抗CD20抗体薬によるADCC活性を抑制するが11),アカラブルチニブにはそのような作用はみられず,両薬剤のオフターゲット作用の違いが影響していると考えられる。
CLLに対する初回治療としてIBTとアカラブルチニブを比較したデータはない。再発・難治性CLLを対象としたIBTとアカラブルチニブの比較試験では,観察期間中央値40.9カ月でのPFSの中央値は両治療群とも38.4カ月で,IBTに対するアカラブルチニブの非劣性が確認された12)。アカラブルチニブは,IBTに比べて心房細動および高血圧が起こる頻度が低く,頭痛や咳嗽の頻度が高かった。IBTとアカラブルチニブの治療効果は同等で,有害事象のプロファイルが異なると考えられる。
参考文献
1) Sivina M, et al. Ibrutinib induces durable remissions in treatment-naïve patients with CLL and 17p deletion and/or TP53 mutations. Blood 2021; 138(24): 2589-92.(3iiiDiii)
2) Ahn IE, et al. Ibrutinib for Chronic Lymphocytic Leukemia with TP53 Alterations. N Engl J Med 2020; 383(5): 498-500.(3iiiDiv)
3) O’Brien S, et al. Single-agent ibrutinib in treatment-naïve and relapsed/refractory chronic lymphocytic leukemia: a 5-year experience. Blood 2018; 131(17): 1910-9.(3iiiDiv)
4) Sharman JP, et al. Acalabrutinib with or without obinutuzumab versus chlorambucil and obinutuzmab for treatment-naive chronic lymphocytic leukaemia(ELEVATE TN): a randomised, controlled, phase 3 trial. Lancet. 2020; 395(10232): 1278-91.(1iiADiii)
5) Sharman JP, et al. Efficacy and safety in a 4-year follow-up of the ELEVATE-TN study comparing acalabrutinib with or without obinutuzumab versus obinutuzumab plus chlorambucil in treatment-naïve chronic lymphocytic leukemia. Leukemia 2022; 36(4): 1171-5.(1iiADiii)
6) Burger JA, et al. Ibrutinib as Initial Therapy for Patients with Chronic Lymphocytic Leukemia. N Engl J Med. 2015; 373(25): 2425-37.(1iiDiii)
7) Burger JA. Long-term efficacy and safety of first-line ibrutinib treatment for patients with CLL/SLL: 5 years of follow-up from the phase 3 RESONATE-2 study. Leukemia. 2020; 34(3): 787-98.(1iiADiii)
8) Shanafelt TD, et al. Ibrutinib-Rituximab or Chemoimmunotherapy for Chronic Lymphocytic Leukemia. N Engl J Med. 2019; 381(5): 432-43.(1iiDiii)
9) Woyach JA, et al. Ibrutinib Regimens versus Chemoimmunotherapy in Older Patients with Untreated CLL. N Engl J Med. 2018; 379(26): 2517-28.(1iiDiii)
10)Burger JA, et al. Randomized trial of ibrutinib vs ibrutinib plus rituximab in patients with chronic lymphocytic leukemia. Blood. 2019; 133(10): 1011-9.(1iiADiii)
11)Fabio Da Roit FD, et al. Ibrutinib interferes with the cell-mediated anti-tumor activities of therapeutic CD20 antibodies: implications for combination therapy. Haematologica 2015; 100(1): 77-86.(3iiiADiv)
12)Byrd JC, et al. Acalabrutinib Versus Ibrutinib in Previously Treated Chronic Lymphocytic Leukemia: Results of the First Randomized Phase III Trial. J Clin Oncol 2021; 39(31): 3441-52.(1iiADiii)
CQ3 CLL初回治療として免疫化学療法は勧められるか
- 推奨グレード
- カテゴリー1
CLL初回治療として免疫化学療法を行うことは推奨されない。
- 推奨グレード
- カテゴリー2B
染色体17p欠失がなく,IGHV変異のあるfitなCLLでは,初回治療としてFCR療法は選択肢の一つである(IGHV変異の検査は国内未承認)。
解説
染色体17p欠失もしくはTP53変異があるCLLは,免疫化学療法に抵抗性である1,2)。BTK阻害薬イブルチニブ(IBT)もしくはアカラブルチニブ±オビヌツズマブによりPFSおよびOSが延長することが示されており,染色体17p欠失もしくはTP53 変異があるCLLに初回治療として免疫化学療法を行うことは推奨されない。
17p欠失のないfitなCLLに対して,FCR療法(FLU,CPA,R)は,IBT+リツキシマブ(R)療法と比べてPFSのみならずOSが劣ることが示されており,初回治療としてFCR療法を行うことは推奨されない。一方,サブグループ解析で,IGHV変異のあるCLLのPFSは,FCR療法とIBT+R療法の間で差がなかった3)。IGHV変異のあるCLLは,FCR療法で優れた治療効果が得られることが報告されており2,4),IBTに劣らない治療効果が得られる可能性がある。IBTは病勢進行もしくは不耐容になるまで長期間継続することが標準的だが,FCR療法は通常6コースと治療期間が限られている。IBTでは有害事象として高血圧,心房細動などの不整脈,出血イベントが起こるが,FCR療法では二次がん,感染症のリスクがある。染色体17p欠失がなく,IGHV変異のあるfitなCLLでは,BTK阻害薬療法と免疫化学療法の特徴と患者の状態を考慮した上で,FCR療法を選択することも可能である(IGHV変異の検査は国内未承認)。
BR療法(BEN,R)は,FCR療法と比較してPFSは有意に劣るが,65歳以上では差がみられず,Grade 3以上の好中球減少と感染症の頻度が低いことより,高齢者CLLに対する初回治療の選択肢の一つとなっている5)。65歳以上のCLLに対して,BR療法とIBT±Rのランダム化比較試験が行われた6)。BR療法のPFSは,IBTに比べて有意に劣っていた。OSに差はなく(BR療法群は,病勢進行後にIBTへの変更が許容された),サブグループ解析でZAP70メチル化症例およびIGHV変異のある症例では両群間でPFSに差が認められなかったが,有害事象はBR療法の方が心房細動,高血圧の頻度は低いものの,血球減少,発熱性好中球減少症の頻度は高く,IBTに比べて安全性が高いとはいえない。65歳以上のCLLに対して初回治療としてBR療法を行うことは推奨されない。
参考文献
1) Hallek M, et al. Addition of rituximab to fludarabine and cyclophosphamide in patients with chronic lymphocytic leukaemia: a randomised, open-label, phase 3 trial. Lancet. 2010; 376(9747): 1164-74.(1iiDiii)
2) Fischer K, et al. Long-term remissions after FCR chemoimmunotherapy in previously untreated patients with CLL: updated results of the CLL8 trial. Blood. 2016; 127(2): 208-15.(1iiDiii/3iiiDiii)
3) Shanafelt TD, et al. Ibrutinib-Rituximab or Chemoimmunotherapy for Chronic Lymphocytic Leukemia. N Engl J Med. 2019; 381(5): 432-43.(1iiDiii)
4) Thompson PA, et al. Fludarabine, cyclophosphamide, and rituximab treatment achieves long-term disease-free survival in IGHV-mutated chronic lymphocytic leukemia. Blood. 2016; 127(3): 303-9.(3iii/3iiiDiii)
5) Eichhorst B, et al. First-line chemoimmunotherapy with bendamustine and rituximab versus fludarabine, cyclophosphamide, and rituximab in patients with advanced chronic lymphocytic leukaemia(CLL10): an international, open-label, randomised, phase 3, non-inferiority trial. Lancet Oncol. 2016; 17(7): 928-42.(1iiDiii)
6) Woyach JA, et al. Ibrutinib Regimens versus Chemoimmunotherapy in Older Patients with Untreated CLL. N Engl J Med. 2018; 379(26): 2517-28.(1iiDiii)
CQ4 イブルチニブ初回治療に治療抵抗性もしくは再発CLLに対する二次治療としてどのような治療が勧められるか
- 推奨グレード
- カテゴリー1
イブルチニブ初回治療に治療抵抗性もしくは再発CLLに対して,ベネトクラクス+リツキシマブ療法が推奨される。
解説
未治療CLLに対するイブルチニブ(IBT)療法では,観察期間中央値60カ月で136例中8例(6%)が病勢進行したと報告されている1)。
再発・難治性CLLに対する4つのIBT±オファツムマブ療法の臨床試験の追跡調査が行われ,観察期間中央値20カ月の時点で308例中18例がRichter症例群,13例がCLLの増悪をきたした2)。病勢進行後に行った遺伝子検査で,Richter症例群を起こした9例中2例,CLLが増悪した11例全員でBTKもしくはPLCG2遺伝子変異が検出された。TP53変異がある,または65歳以上のCLLを対象に行われたIBT療法の臨床試験では,観察期間中央値34.3カ月の時点で86例中15例が病勢進行した3)。5例がRichter症候群を起こし,検査を行った3例中1例でPLCG2遺伝子変異を認めた。CLLが増悪した10例中8例でBTKおよび/またはPLCG2遺伝子変異が認められた。これらの遺伝子変異は,病勢進行の最長15カ月前に検出され,異なる変異を持つ複数のサブクローンが認められた。IBT療法中にCLL細胞のBTKもしくはPLCG2遺伝子変異が起こり,IBT耐性クローンが増加してCLLが増悪・再燃すると考えられる。
BCL-2阻害薬ベネトクラクス(VEN)は,再発・難治性CLLに対して優れた治療効果が報告されている。BR療法(BEN,R)とVEN+Rのランダム化比較試験では,VEN群の方がPFS,OSとも有意に延長した4)。VEN群に特徴的な有意事象として3.1%で腫瘍崩壊症候群が起こり,BEN群に比べて好中球減少の頻度が高かったが,発熱性好中球減少症や感染症の頻度は低く,安全性に問題はなかった。この試験には,BTK阻害薬の治療歴がある患者は2.6%しか含まれていない。
IBTに不応性もしくは再発した91例のCLLに対してVEN療法が実施された5)。観察期間中央値14カ月の時点で,65%で奏効(9%でCR)が得られ,PFSの中央値は24.7カ月,1年OSは91%であった。治療前に検査した21例中17例(81%)でBTKもしくはPLCG2遺伝子変異を認めたが,変異の有無によりVEN療法のPFSに差はみられなかった。IBT抵抗性のCLLに対してVENは有効な治療法と考えられる。
IBTもしくはPI3Kδ阻害薬idelalisib療法を行ったCLL 683例の後方視的解析が行われた6)。IBT療法を受けた患者の20.5%は病勢進行し,後治療としてVEN,idelalisib,免疫化学療法が行われた。免疫化学療法群のPFSは,VEN群およびidelalisib群と比べて有意に低かった。IBT抵抗性のCLLに対して免疫化学療法は推奨されない。
アカラブルチニブは新規に開発されたBTK阻害薬で,IBTに比べてより選択的にBTKを阻害する。再発・難治性CLLに対するIBTとアカラブルチニブの比較試験では,有害事象の種類と頻度に差がみられたが治療効果は同等であった7)。IBT不耐容のCLLに対して高い忍容性および有効性が確認されているが(CQ5参照),IBT抵抗性のCLLに対するアカラブルチニブの治療効果は検証されておらず,その有効性は不明である。
参考文献
1) Burger JA. Long-term efficacy and safety of first-line ibrutinib treatment for patients with CLL/SLL: 5 years of follow-up from the phase 3 RESONATE-2 study. Leukemia. 2020; 34(3): 787-98.(1iiADiii)
2) Maddocks KJ, et al. Etiology of Ibrutinib Therapy Discontinuation and Outcomes in Patients With Chronic Lymphocytic Leukemia. JAMA Oncol. 2015; 1(1): 80-7.(3iiiD)
3) Ahn IE, et al. Clonal evolution leading to ibrutinib resistance in chronic lymphocytic leukemia. Blood. 2017; 129(11): 1469-79.(3iiiDi)
4) Seymour JF, et al. Venetoclax-Rituximab in Relapsed or Refractory Chronic Lymphocytic Leukemia. N Engl J Med. 2018; 378(12): 1107-20.(1iiD)
5) Jones JA, et al. Venetoclax for chronic lymphocytic leukaemia progressing after ibrutinib: an interim analysis of a multicentre, open-label, phase 2 trial. Lancet Oncol. 2018; 19(1): 65-75.(2Div)
6) Mato AR, et al. Optimal sequencing of ibrutinib, idelalisib, and venetoclax in chronic lymphocytic leukemia: results from a multicenter study of 683 patients. Ann Oncol. 2017; 28(5): 1050-6.(3iiiDiii)
7) Byrd JC, et al. Acalabrutinib Versus Ibrutinib in Previously Treated Chronic Lymphocytic Leukemia: Results of the First Randomized Phase III Trial. J Clin Oncol 2021; 39(31): 3441-52.(1iiADiii)
CQ5 イブルチニブ初回治療に治療不耐容のCLLに対する二次治療としてどのような治療が勧められるか
- 推奨グレード
- カテゴリー1
イブルチニブ初回治療の治療不耐容のCLLに対して,ベネトクラクス+リツキシマブ療法,アカラブルチニブが推奨される。
解説
未治療CLLに対するイブルチニブ(IBT)療法では,観察期間中央値60カ月で136例中56例(41%)が治療を中止し,そのうち29例(21%)は心房細動,動悸,肺炎などの有害事象が原因と報告されている1)。再発・難治性CLLに対する4つのIBT±オファツムマブの臨床試験では,観察期間中央値20カ月の時点で308例中45例が病勢進行以外の原因で治療を中止し,そのうち28例は感染症,8例は他の有害事象が原因であった2)。
IBTに不応性もしくは再発したCLL 91例を対象に,BCL-2阻害薬ベネトクラクス(VEN)療法が実施された3)。観察期間中央値14カ月の時点で,65%で奏効(9%でCR)が得られ,PFSの中央値は24.7カ月,1年OSは91%であった。有害事象でIBTを中止した30例の全奏効率は63%,病勢進行で中止した50例では54%であった。頻度の高い有害事象は好中球減少,悪心,貧血,下痢,血小板減少で,6例(7%)が有害事象で治療を中止した。IBT不耐容のCLLに対してVENは有効な治療法と考えられる。
BTK阻害薬アカラブルチニブは,IBTに比べてより選択的にBTKを阻害する。IBTに不耐容のCLLを対象に,アカラブルチニブ療法の臨床試験が行われた4)。観察期間中央値19.0カ月の時点で,33例中23例(70%)がアカラブルチニブ療法を継続しており,4例が病勢進行,3例が有害事象(子宮内膜癌,出血性脳卒中,アスペルギルス感染症),3例が担当医の判断で治療を中止した。IBT不耐容の原因となった有害事象のうち,72%はアカラブルチニブでは起こらず,13%は再燃したがIBTに比べて低Gradeであった。全奏効率は76%,1年および2年PFSは83.4%,75.0%であった。IBT不耐容のCLL 60例に対するアカラブルチニブ療法では,73%で奏効(5%でCR)が得られ,2年PFSおよびOSは72%と81%であった5)。治療前に検査をした55例中3例でBTKもしくはPLCG2遺伝子変異が検出された。1例は治療を中止。1例は最大治療効果が安定(SD)で15カ月後に病勢進行し,BTK遺伝子変異を持つクローンが治療前の30.7%から90.2%に増加していた。1例はPLCG2D993N変異が認められたが,アカラブルチニブ療法でCRが得られ25カ月治療を継続中である。アカラブルチニブは,BTK阻害薬の適応であるが有害事象のためIBTを継続できないCLLに対して忍容性が高く,二次治療として適している。
IBTもしくはPI3Kδ阻害薬idelalisib療法を行ったCLL 683例の後方視的解析が行われ,IBTの51.2%は有害事象のため治療が中止された6)。後治療としてVEN,idelalisib,免疫化学療法が行われたが,免疫化学療法を受けた患者のPFSは,VEN群と比べて有意に低かった。IBT不耐容のCLLに対して免疫化学療法は推奨されない。
参考文献
1) Burger JA. Long-term efficacy and safety of first-line ibrutinib treatment for patients with CLL/SLL: 5 years of follow-up from the phase 3 RESONATE-2 study. Leukemia. 2020; 34(3): 787-98.(1iiADiii)
2) Maddocks KJ, et al. Etiology of Ibrutinib Therapy Discontinuation and Outcomes in Patients With Chronic Lymphocytic Leukemia. JAMA Oncol. 2015; 1(1): 80-7.(3iiiDi)
3) Jones JA, et al. Venetoclax for chronic lymphocytic leukaemia progressing after ibrutinib: an interim analysis of a multicentre, open-label, phase 2 trial. Lancet Oncol. 2018; 19(1): 65-75.(2Div)
4) Awan FT, et al. Acalabrutinib monotherapy in patients with chronic lymphocytic leukemia who are intolerant to ibrutinib. Blood Adv. 2019; 3(9): 1553-62.(3iiiA)
5) Rogers KA, et al. Phase II study of acalabrutinib in ibrutinib-intolerant patients with relapsed/refractory chronic lymphocytic leukemia. Haematologica. 2021; 106(9): 2364-73.(3iiiDiv)
6) Mato AR, et al. Optimal sequencing of ibrutinib, idelalisib, and venetoclax in chronic lymphocytic leukemia: results from a multicenter study of 683 patients. Ann Oncol. 2017; 28(5): 1050-6.(3iiiDiii)
CQ6 17p欠失もしくはTP53変異を有する高リスクCLLに対してどのような治療が勧められるか
- 推奨グレード
- カテゴリー1
分子標的治療,特にBTK阻害薬を推奨する。免疫化学療法は,p53異常(17p欠失もしくはTP53変異)例では十分な治療効果が期待できない。
解説
p53異常を有するCLLへの免疫化学療法の治療成績は不良で,奏効率,PFS,OSいずれも低下する1,2)。免疫化学療法時代の生存予後指標であるInternational Prognostic Index for CLL(CLL-IPI)(総論・予後因子参照)では,p53異常に最大の重み付け(4点)がされている。他の4因子は1~2点であり,p53異常は免疫化学療法治療後の生存を悪化させる最大の要因である。実際,p53異常のみでhighリスク(4~6点)となる。さらに,p53異常以外の4項目の総和は6点だから,very highリスク(7点以上)では必ずp53異常を有することになる。よって,免疫化学療法は推奨されない。
分子標的治療のうち,初回治療としての保険適用があるのはBTK阻害薬[イブルチニブ(IBT)もしくはアカラブルチニブ±オビヌツズマブ]である。BTK阻害薬を初回治療として用いる場合,p53異常が患者生存に与える悪影響は,免疫化学療法と比較して少ない3-5)。IBT治療例の生存予後因子Four-Factor score(総論・予後因子参照)では,4因子うちp53異常が与えるハザード比は治療歴よりも低く,さらにp53異常のみではlowリスクで最も優れた群に層別化される。アカラブルチニブ初回治療を検証したELEVATE TN試験では,17p欠失によるPFSの悪化はみられておらず,アカラブルチニブもIBTと同様,p53異常例への優れた有効性が期待できる5)。VEN+Rは二次治療以降で保険適用を有するが,p53異常の有無にかかわらず免疫化学療法と比較し高い有効性を示す6)。ただし,初回VEN+オビヌツズマブを検証したCLL14試験7)でも,二次治療を対象にしたMURANO試験同様,17p欠失がある例では,ない例に比較してPFSの低下がみられている。
分子標的治療により,免疫化学療法では予後が極めて不良であったp53異常例の予後は改善したが,さらなる改善のため,BTK阻害薬とBCL-2阻害薬の併用療法などが試みられている8)。BTK阻害薬とBCL-2阻害薬の併用療法は現時点では保険適用されていない。シーケンシャル治療は医学的根拠に乏しく,現時点では推奨しない。
参考文献
1) Stilgenbauer S, et al. Gene mutations and treatment outcome in chronic lymphocytic leukemia: results from the CLL8 trial. Blood. 2014; 123(21): 3247-54.(1iiADiii)
2) Fischer K, et al. Bendamustine in combination with rituximab for previously untreated patients with chronic lymphocytic leukemia: a multicenter phase II trial of the German Chronic Lymphocytic Leukemia Study Group. J Clin Oncol. 2012; 30(26): 3209-16.(3iiiA)
3) Sivina M, et al. Ibrutinib induces durable remissions in treatment-naïve patients with CLL and 17p deletion and/or TP53 mutations. Blood. 2021; 138(24): 2589-92.(3iiiDiii)
4) Ahn IE, et al. Ibrutinib for Chronic Lymphocytic Leukemia with TP53 Alterations. N Engl J Med. 2020; 383(5): 498-500.(3iiiDiv)
5) Sharman JP, et al. Acalabrutinib with or without obinutuzumab versus chlorambucil and obinutuzmab for treatment-naive chronic lymphocytic leukaemia(ELEVATE TN): a randomised, controlled, phase 3 trial. Lancet. 2020; 395(10232): 1278-91.(1iiADiii)
6) Kater AP, et al. Venetoclax Plus Rituximab in Relapsed Chronic Lymphocytic Leukemia: 4-Year Results and Evaluation of Impact of Genomic Complexity and Gene Mutations From the MURANO Phase III Study. J Clin Oncol. 2020; 38(34): 4042-54.(1iiADiii)
7) Al-Sawaf O, et al. Minimal Residual Disease Dynamics after Venetoclax-Obinutuzumab Treatment: Extended Off-Treatment Follow-up From the Randomized CLL14 Study. J Clin Oncol. 2021; 39(36): 4049-60.(1iiADiii)
8) Jain N, et al. Ibrutinib and Venetoclax for First-Line Treatment of CLL. N Engl J Med. 2019; 380(22): 2095-103.(3iiiDiv)
CQ7 自己免疫性溶血性貧血,自己免疫性血小板減少症を合併したCLLに対してステロイド治療は勧められるか
- 推奨グレード
- カテゴリー2A
CLLが無症候性・非活動性ならば,自己免疫性血球減少症に対してステロイド治療が勧められる。症候性・活動性病態,あるいはステロイドが無効の自己免疫性血球減少症では,分子標的治療を中心としたCLL治療を考慮する。
解説
CLL患者の10%程度が,経過中に自己免疫性血球減少症(autoimmune cytopenia : AIC)を合併する。iwCLLガイドライン(総論・治療参照)にあるように,無症候性・非活動性CLLに合併したAICに対してはステロイド治療が第一選択である。ステロイド無効例に対して,以前はシクロスポリンやリツキシマブ(R)単剤治療,免疫化学療法が行われてきたが1-3),近年は分子標的治療が選択されるようになってきた。症候性・活動性病態におけるAICに対してはCLL治療を考慮する。
CLL治療のうち,免疫化学療法はCLLに対する有効性が分子標的治療より劣るため,通常は分子標的治療が適応とならないときに考慮する。フルダラビン(FLU)単剤治療はAIC,特に自己免疫性溶血性貧血(autoimmune hemolytic anemia:AIHA)を惹起・悪化させる懸念があり勧められないが,シクロホスファミド(CPA)やRとの併用でリスクが低下する3,4)。BR療法(BEN,R)は,CLL,AICいずれに対しても長期コントロールに懸念がある5)。
分子標的治療では,慢性GVHDなど免疫異常に用いられるイブルチニブ(IBT)で臨床データが蓄積しており,選択しやすい6-8)。最近報告された多数例の後方視的解析では,既存のAICをIBTが悪化させた症例はなく(0/66例),新規のAIC発生も1%(5/506例)と低かった8)。IBT開始時にAICが寛解期であった25例は全例が寛解を維持し,活動性AICの16例でも,9例がIBTで寛解(うち2例はステロイド併用),6例が改善(うち2例はステロイド併用,1例はステロイド・R併用),1例は安定に至った。ベネトクラクス(VEN)では9例中1例に既存のAICの悪化を,91例中6例(7%)に新規のAIC発生を認めたという。アカラブルチニブのデータはまだ乏しいが,11例のAIC既往例でアカラブルチニブ治療中に再燃したのは1例のみであったと報告されている9)。
参考文献
1) Cortes J, et al. Cyclosporin A for the treatment of cytopenia associated with chronic lymphocytic leukemia. Cancer. 2001; 92(8): 2016-22.(3iiiDiv)
2) D’Arena G, et al. Rituximab therapy for chronic lymphocytic leukemia-associated autoimmune hemolytic anemia. Am J Hematol. 2006; 81(8): 598-602.(3iiiDiv)
3) Dearden C, et al. The prognostic significance of a positive direct antiglobulin test in chronic lymphocytic leukemia: a beneficial effect of the combination of fludarabine and cyclophosphamide on the incidence of hemolytic anemia. Blood. 2008; 111(4): 1820-6.(1iiDiv)
4) Borthakur G, et al. Immune anaemias in patients with chronic lymphocytic leukaemia treated with fludarabine, cyclophosphamide and rituximab--incidence and predictors. Br J Haematol. 2007; 136(6): 800-5.(3iiiDiv)
5) Quinquenel A, et al. Bendamustine and rituximab combination in the management of chronic lymphocytic leukemia-associated autoimmune hemolytic anemia: a multicentric retrospective study of the French CLL intergroup(GCFLLC/MW and GOELAMS). Am J Hematol. 2015; 90(3): 204-7.(3iiiDiv)
6) Montillo M, et al. Ibrutinib in previously treated chronic lymphocytic leukemia patients with autoimmune cytopenias in the RESONATE study. Blood Cancer J. 2017; 7(2): e524.(1iiDiii)
7) Hampel PJ, et al. Autoimmune cytopenias in patients with chronic lymphocytic leukaemia treated with ibrutinib in routine clinical practice at an academic medical centre. Br J Haematol. 2018; 183(3): 421-7.(3iiiDiv)
8) Vitale C, et al. Preexisting and treatment-emergent autoimmune cytopenias in patients with CLL treated with targeted drugs. Blood. 2021; 137(25): 3507-17.(3iiiDiv)
9) Byrd JC, et al. Acalabrutinib monotherapy in patients with relapsed/refractory chronic lymphocytic leukemia: updated phase 2 results. Blood. 2020; 135(15): 1204-13.(3iiiDiv)
CQ8 組織学的形質転換をきたしたCLL(Richter症候群)に対してどのような治療が勧められるか
- 推奨グレード
- カテゴリー2B
病理組織診断に応じた化学療法が勧められる。びまん性大細胞型B細胞リンパ腫,特にCLLクローン由来の例では,免疫化学療法で奏効が得られれば,第一寛解期での造血幹細胞移植も考慮する。
解説
CLLは時にRichter症候群(組織学的形質転換)をきたし,急激な病勢進行を示す。臨床試験に登録された初回治療患者を対象にしたドイツグループからの後方視的解析によれば,観察期間中央値53カ月でRichter症候群は3.5%(2,975例中103例)にみられ,大多数(103例中95例,92%)はびまん性大細胞型B細胞リンパ腫(DLBCL)に,一部(103例中8例,8%)はホジキンリンパ腫(HL)への転換をきたしたと報告されている1)。Richter症候群は,進行例や,p53異常,unmutated IGHV(総論・予後因子参照)など,予後不良因子を有する例で起きやすい2)。DLBCL型Richter症候群の多くは,de novo DLBCLとは異なる特徴的な遺伝子異常・発現プロファイルを示す2,3)。
Richter症候群が疑われる例では生検を施行し,病理診断に基づいた治療を行う。生検部位の選定に,PET-CT検査はしばしば有益である。DLBCL型Richter症候群の80%はCLLクローン由来に由来し,残りは無関係である。いずれもR-CHOPに代表される免疫化学療法を行うが,CLL由来DLBCLでは奏効率が50~60%と低く,転換後の生存期間中央値も約1年と予後不良4)のため,完全もしくは部分寛解が得られれば,移植適応年齢の患者では造血幹細胞移植,特に同種移植の適応を検討する。DLBCL型Richter症候群に対してR-CHOP療法(R,CPA,DXR,VCR,PSL)より治療強度の高い免疫化学療法も試みられてきたが,完全寛解率の増加が高度の骨髄抑制や感染症の合併,治療関連死亡の増加に相殺され,R-CHOP療法を凌駕する生存率の向上が得られていない。免疫化学療法に高い感受性を示した例では,同種移植とともに自家造血幹細胞移植も選択肢となるが,免疫化学療法治療歴のある進行期CLLやp53異常例などでは有効性が低下する懸念がある5-7)。同種移植では,前処置として低強度前処置(reduced intensity conditioning:RIC)が選択されることが多い(CQ9参照)6,7)。CLLクローンとは無関係のDLBCL型Richter症候群では,免疫化学療法後の生存期間中央値は5年程度と報告されており,CLL由来DLBCLに比べて予後が良い。免疫グロブリン遺伝子再構成の比較解析が可能な例では,クローン相同性評価を考慮する。HL型Richter症候群では,ABVD療法(DXR,BLM,VBL,DTIC)など通常のHLに準じた化学療法を行う8)。DLBCL型と比較して,HL型Richter症候群の予後は良好であることから,第一寛解期での造血幹細胞移植は一般的ではない。分子標的薬によるRichter症候群の治療は研究段階であり,データに乏しい。
参考文献
1) Al-Sawaf O, et al. Richter transformation in chronic lymphocytic leukemia(CLL)-a pooled analysis of German CLL Study Group(GCLLSG)front line treatment trials. Leukemia. 2021; 35(1): 169-76.(3iiiDiv)
2) Rossi D, et al. The genetics of Richter syndrome reveals disease heterogeneity and predicts survival after transformation. Blood. 2011; 117(12): 3391-401.(3iiiA)
3) Klintman J, et al. Genomic and transcriptomic correlates of Richter transformation in chronic lymphocytic leukemia. Blood. 2021; 137(20): 2800-16.(3iiiDiv)
4) Langerbeins P, et al. Poor efficacy and tolerability of R-CHOP in relapsed/refractory chronic lymphocytic leukemia and Richter transformation. Am J Hematol. 2014; 89(12): E239-43.(2Div)
5) Wang Y, et al Clinical characteristics and outcomes of Richter transformation: experience of 204 patients from a single center. Haematologica. 2020; 105(3): 765-73.(3iiiDiv)
6) Herrera AF, et al. Autologous and allogeneic hematopoietic cell transplantation for diffuse large B-cell lymphoma-type Richter syndrome. Blood Adv. 2021; 5(18): 3528-39.(3iiiA)
7) Cwynarski K, et al. Autologous and allogeneic stem-cell transplantation for transformed chronic lymphocytic leukemia(Richter’s syndrome): A retrospective analysis from the chronic lymphocytic leukemia subcommittee of the chronic leukemia working party and lymphoma working party of the European Group for Blood and Marrow Transplantation. J Clin Oncol. 2012; 30(18): 2211-7.(3iiiA)
8) Stephens DM, et al. Hodgkin lymphoma arising in patients with chronic lymphocytic leukemia: outcomes from a large multi-center collaboration. Haematologica. 2021; 106(11): 2845-52.(3iiiA)
CQ9 再発・難治性CLLに対して造血幹細胞移植は勧められるか
- 推奨グレード
- カテゴリー2B
分子標的治療抵抗性の場合,同種造血幹細胞移植を考慮する。
解説
CLLにおいては,自家造血幹細胞移植は移植を行うタイミングにかかわらず有益性が乏しく,推奨されない1-3)。同種造血幹細胞移植においても,CLLが高齢者に多いことに加え,新規分子標的薬であるBTK阻害薬IBT,アカラブルチニブとBCL-2阻害薬ベネトクラクス(VEN)の臨床導入により,同種移植が果たす役割は限られている。CLLに対する同種移植施行例は米国でも年間100例程度まで減少していることから,質の高いエビデンスを得ることは難しく,ガイドラインごとに同種移植の適応について若干の違いが認められる。一般に,同種移植の前処置としてはRICが推奨され,移植細胞ソースとしては末梢血幹細胞(peripheral blood stem cells)が好まれる4,5)。
初回免疫化学療法後の再発・難治例に対しては,分子標的治療(BTK阻害薬,BCL-2阻害薬)を行う。同種移植は推奨されない。ただし,p53 異常(17p欠失もしくはTP53変異)を有する初回免疫化学療法無効例では,もし移植関連合併症のリスクが低いと予想され,二次治療としての分子標的治療で奏効を得たら,オプションとして同種移植へ進む選択肢を考慮する。BTK阻害薬,BCL-2阻害薬いずれにも抵抗性を示した場合,免疫化学療法の効果は期待できないから,同種移植を考慮する6,7)。免疫化学療法が一般的でなくなった現在では,初回分子標的治療(本邦では通常BTK阻害薬)無効例の二次治療での分子標的治療(通常BCL-2阻害薬)中が,同種移植を考慮するタイミングとなる8)。なお,p53 異常に加え,複雑核型(3つ以上の染色体異常)を同種移植の適応にあたり考慮することがあるが,日常診療で行う未刺激法による染色体分析で分裂期CLL細胞が得られる頻度は10%程度と感度が低いことに注意が必要である。Richter症候群に対する同種移植の適応についてはCQ8に記述した。
同種移植はCLLに対する唯一の根治的治療であり,ドイツグループからの最近のアップデート報告では,RICによる同種移植を受けた予後不良のCLL患者90例の10年PFSは34%,10年OSは51%と報告されている9)。p53異常があっても長期生存が期待できる9,10)ことは,同種移植のアドバンテージである。一方で,非共有結合型BTK阻害薬やCAR-T細胞療法などの新規治療の臨床開発も進んでいることから11,12),同種移植を考慮した時点での新規治療の開発状況を踏まえ,同種移植と併せて検討を行うことが望ましい。
参考文献
1) Michallet M, et al. Autologous hematopoietic stem cell transplantation in chronic lymphocytic leukemia: results of European intergroup randomized trial comparing autografting versus observation. Blood. 2011; 117(5): 1516-21.(1iiDi)
2) Magni M, et al. Results of a randomized trial comparing high-dose chemotherapy plus Auto-SCT and R-FC in CLL at diagnosis. Bone Marrow Transplant. 2014; 49(4): 485-91.(1iiDiv)
3) Reljic T, et al. High-dose therapy and autologous hematopoietic cell transplantation as front-line consolidation in chronic lymphocytic leukemia: a systematic review. Bone Marrow Transplant. 2015; 50(8): 1069-74.(レビュー)
4) Kharfan-Dabaja MA, et al. Reduced intensity is preferred over myeloablative conditioning allogeneic HCT in chronic lymphocytic leukemia whenever indicated: A systematic review/meta-analysis. Hematol Oncol Stem Cell Ther. 2018; 11(2): 53-64.(3iiiA)
5) Kharfan-Dabaja MA, et al. Clinical Practice Recommendations for Use of Allogeneic Hematopoietic Cell Transplantation in Chronic Lymphocytic Leukemia on Behalf of the Guidelines Committee of the American Society for Blood and Marrow Transplantation. Biol Blood Marrow Transplant. 2016; 22(12): 2117-25.(ガイドライン)
6) Eichhorst B, et al. Chronic lymphocytic leukaemia: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2021; 32(1): 23-33.(ガイドライン)
7) NCCN Clinical Practice Guidelines in Oncology. Chronic Lymphocytic Leukemia/Small Lymphocytic Lymphoma. Version 3.2022.(ガイドライン)
8) Roeker LE, et al. Allogeneic stem cell transplantation for chronic lymphocytic leukemia in the era of novel agents. Blood Adv. 2020; 4(16): 3977-89.(3iiiDiii)
9) Krämer I, et al. Allogeneic hematopoietic cell transplantation for high-risk CLL: 10-year follow-up of the GCLLSG CLL3X trial. Blood. 2017; 130(12): 1477-80.(3iiiA)
10)Schetelig J, et al. Allogeneic hematopoietic stem-cell transplantation for chronic lymphocytic leukemia with 17p deletion: a retrospective European Group for Blood and Marrow Transplantation analysis. J Clin Oncol. 2008; 26(31): 5094-100.(3iiiA)
11)Mato AR, et al. Pirtobrutinib in relapsed or refractory B-cell malignancies(BRUIN): a phase 1/2 study. Lancet. 2021 Mar 6; 397(10277): 892-901.(3iiiDiv)
12)Gauthier J, et al. Feasibility and efficacy of CD19-targeted CAR T cells with concurrent ibrutinib for CLL after ibrutinib failure. Blood. 2020; 135(19): 1650-60.(3iiiDiv)

